题目内容
4.有机物其结构如图所示,下列关于该有机物的性质描述正确的是( )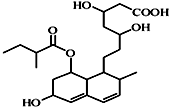
| A. | 不能使酸性KMnO4溶液褪色 | B. | 该有机物中-OH能氧化为-CHO | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
分析 该有机物含有酯基、羟基、羧基和碳碳双键,可从酯类物质、醇、烯烃以及羧酸的角度分析该有机物可能具有的性质.
解答 解:A.分子中含有碳碳双键和羟基,可与酸性高锰酸钾发生氧化还原反应,故A错误;
B.分子中不含-CH2OH原子团,则不能被氧化为-CHO,故B错误;
C.含有碳碳双键,可发生加成反应,含有羟基和羧基,可发生取代反应,含有羟基,且邻位碳原子上含有氢原子,可发生消去反应,故C正确;
D.分子中含有1个酯基和1个羧基,则1mol该物质最多可与2molNaOH反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生分析能力和综合运用化学知识的能力的考查,注意把握有机物的结构和官能团的性质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.已知反应:①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol,
②稀溶液中,H+(aq)+OH- (aq)═H2O(1);△H=-57.3kJ/mol,下列结论正确的是( )
②稀溶液中,H+(aq)+OH- (aq)═H2O(1);△H=-57.3kJ/mol,下列结论正确的是( )
| A. | 碳的燃烧热为110.5kJ/mol | |
| B. | 因为反应①中的△H<0,△S>0,所以该反应在一定条件下可以自发进行 | |
| C. | 反应①中反应物的总键能大于生成物的总键能 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
12.已知:(Q1、Q2为正数)
(1)胆矾失水的热化学方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H=-Q2kJ•mol-1
(3)胆矾(CuSO4•5H2O)溶于水时溶液温度降低.则 Q1与Q2的关系是( )
(1)胆矾失水的热化学方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H=-Q2kJ•mol-1
(3)胆矾(CuSO4•5H2O)溶于水时溶液温度降低.则 Q1与Q2的关系是( )
| A. | Q 1=Q 2 | B. | Q 1>Q 2 | C. | Q 1<Q 2 | D. | 无法确定 |
19.下列关于热化学反应的描述中正确的是( )
| A. | 放热反应中反应物的总能量低于生成物的总能量 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 6g冰醋酸所含σ键数目为0.7NA | |
| B. | 1L 0.2mol/L的硫酸铝溶液中铝离子的物质的量为0.4NA | |
| C. | 6.72 LNO2和足量水完全反应,转移电子数是2NA | |
| D. | 标准状况下,11.2LN2和33.6LH2混合反应后可生成标况下的氨气22.4L |
13.下列说法正确的是( )
| A. | 待测液中加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,则待测液中一定有硫酸根离子 | |
| B. | 用灼烧的方法可鉴别丝绸与棉布 | |
| C. | 无色溶液中加入Na2CO3溶液产生白色沉淀,则该无色溶液中含有Ca2+ | |
| D. | 待测液中加入AgNO3溶液,有白色沉淀生成,则待测液中含有Cl- |
14.下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
| 实验 | 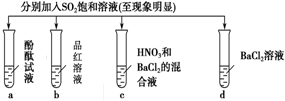 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| C | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| A. | A | B. | B | C. | C | D. | D |