题目内容
1.下列各图所示的实验原理、方法、装置或操作,其中正确的是( )| A. |  向容量瓶中转移溶液 | B. |  中和热的测定 | ||
| C. | 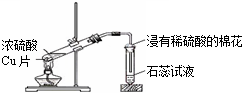 浓硫酸与铜的反应 | D. |  乙二酸晶体受热分解 |
分析 A.转移液体需要使用玻璃棒引流;
B.中和热的测定需要使用环形玻璃搅拌棒;
C.二氧化硫能使品红褪色;
D.乙二酸分解产物是CO2、CO和H2O.
解答 解:A.转移液体需要使用玻璃棒引流,以免液体溅出,故A错误;
B.中和热的测定需要使用环形玻璃搅拌棒,注意保温,故B正确;
C.二氧化硫能使品红褪色,石蕊试液只能说明气体呈酸性,故C错误;
D.乙二酸分解产物是CO2、CO和H2O,应先检验水,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及转移液体、中和热测定及物质性质实验等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
11.对牙膏的探究要用到许多化学知识.
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别.
(2)根据你的推测,牙膏摩擦剂的溶解性是难溶(填“易溶”或“难溶”).
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为:[石灰石]$\stackrel{①高温}{→}$[生石灰]$\stackrel{②加水}{→}$[石灰水]$\stackrel{③加Na_{2}CO_{3}溶液}{→}$[碳酸钙]
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO 分解反应;
②CaO+H2O═Ca(OH)2 化合反应;
③Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 复分解反应.
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石-→
你设计的方案的优点为:反应条件简单,易于操作,所得产品纯度高.
(5)检验牙膏中是否含有碳酸钙的实验方法是:取少量样品,加入稀盐酸,观察有无使澄清石灰水变浑浊的气体产生,若有,则含CaCO3,否则不含.
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别.
| 牙膏 | 两面针儿童牙膏 | 珍珠王防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) |
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为:[石灰石]$\stackrel{①高温}{→}$[生石灰]$\stackrel{②加水}{→}$[石灰水]$\stackrel{③加Na_{2}CO_{3}溶液}{→}$[碳酸钙]
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO 分解反应;
②CaO+H2O═Ca(OH)2 化合反应;
③Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 复分解反应.
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石-→
你设计的方案的优点为:反应条件简单,易于操作,所得产品纯度高.
(5)检验牙膏中是否含有碳酸钙的实验方法是:取少量样品,加入稀盐酸,观察有无使澄清石灰水变浑浊的气体产生,若有,则含CaCO3,否则不含.
13.对于CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ•mol-1的叙述正确的是( )
| A. | 该反应是吸热反应 | |
| B. | 反应的△H与各物质的状态有关,与化学计量数也有关 | |
| C. | 由方程式可知,CH4的燃烧热为802.3 kJ•mol-1 | |
| D. | 该式的含义为:25℃、101 kPa下,1molCH4气体完全燃烧生成CO2和液态水时放出热量802.3kJ |
10.中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性.在 25℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| $\frac{浓度}{(mol•{L}^{_1})}$ | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
 ═2KCl+2MnCl2+5Cl2↑+8H2O
═2KCl+2MnCl2+5Cl2↑+8H2O
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.