题目内容
13.对于CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ•mol-1的叙述正确的是( )| A. | 该反应是吸热反应 | |
| B. | 反应的△H与各物质的状态有关,与化学计量数也有关 | |
| C. | 由方程式可知,CH4的燃烧热为802.3 kJ•mol-1 | |
| D. | 该式的含义为:25℃、101 kPa下,1molCH4气体完全燃烧生成CO2和液态水时放出热量802.3kJ |
分析 A、焓变为负值是放热反;
B、反应焓变和物质聚集状态和定量关系有关,物质聚集状态不同,计量数不同,反应的焓变不同;
C、根据燃烧热的含义:完全燃烧1mol纯物质生成最稳定的氧化物所放出的能量;
D、热化学方程式中生成的水为气体,结合热化学方程式分析.
解答 解:A、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ•mol-1,焓变为负值是放热反应,故A错误;
B、焓变的影响因素:物质的状态、物质的量的多少以及物质前面化学计量数的大小,故B正确;
C、燃烧热的含义:完全燃烧1mol纯物质生成最稳定的氧化物所放出的能量,热化学方程式中生成的水不是我的氧化物,故C错误.
D、该式的含义为:25℃、101 kPa下,1molCH4气体完全燃烧生成CO2和气态水时放出热量802.3kJ,故D错误;
故选B.
点评 本题考查学生让化学方程式的含义以及焓变的影响因素、燃烧热的含义等知识,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
3.以水为分散剂的分散系,按稳定性由强到弱的顺序排列的是( )
| A. | 溶液、胶体、浊液 | B. | 浊液、胶体、溶液 | C. | 胶体、浊液、溶液 | D. | 浊液、溶液、胶体 |
4.下列关于气体摩尔体积的几种说法正确的是( )
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 非标准状况下,1mol任何气体不可能占有22.4L体积 | |
| C. | 0.4.molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L | |
| D. | 同温、同压下,相同质量的CO和CO2具有相同的体积 |
1.下列各图所示的实验原理、方法、装置或操作,其中正确的是( )
| A. |  向容量瓶中转移溶液 | B. |  中和热的测定 | ||
| C. | 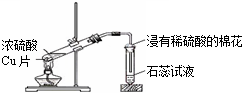 浓硫酸与铜的反应 | D. |  乙二酸晶体受热分解 |
8.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1 NA个原子 | |
| C. | 23g钠在22.4L(标况下)Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 |
18.下列事实中不能应用勒夏特列原理来解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 高压对合成氨有利 | |
| C. | 将NO2和N2O4的混合气体降温后,气体颜色变浅 | |
| D. | 加入催化剂能使合成氨的速率加快 |
5.下列关于甲烷的说法正确的是( )
| A. | 能使溴的四氯化碳溶液褪色 | B. | 是天然气的主要成分 | ||
| C. | 不能发生燃烧反应 | D. | 能发生加成反应 |
2.下列过程中,属于非自发过程的是( )
| A. | N2和O2混合 | B. | 常温、常压下,石墨转化为金刚石 | ||
| C. | H2和O2化合生成H2O | D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA | |
| C. | 标准状况下,11.2L CCl4中含有分子的数目为0.5NA | |
| D. | 室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |