题目内容
12.现有三组溶液:?汽油和氯化钠溶液 ②39%的酒精溶液 ③硝酸钾和氯化钠的混合溶液,分离以上各混合液的正确方法依次是分液、蒸馏、冷却结晶(填“过滤”、“萃取”、“分液”、“蒸馏”、“冷却结晶”等).分析 ①汽油和氯化钠溶液,混合分层;②39%的乙醇溶液中乙醇与水的沸点不同,③硝酸钾和氯化钠的溶解度受温度影响不同,以此来解答.
解答 解:①汽油和氯化钠溶液,混合分层,则选择分液法分离;
②39%的乙醇溶液中乙醇与水的沸点不同,则选择蒸馏法分离;
③硝酸钾和氯化钠的溶解度受温度影响不同,则选择冷却结晶法分离,
故答案为:分液;蒸馏;冷却结晶.
点评 本题考查混合物分离、提纯的方法及选择,为高频考点,把握物质的性质及性质差异、混合物分离方法为解答的关键,注重实验基础知识和基本技能的考查,注意有机物性质,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2. 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.1 mol/(L•min) | |
| B. | T1<T2,正反应为吸热反应 | |
| C. | 平衡时保持温度不变,缩小容器体积平衡向正反应方向移动 | |
| D. | T1℃时,若起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为75% |
3.以水为分散剂的分散系,按稳定性由强到弱的顺序排列的是( )
| A. | 溶液、胶体、浊液 | B. | 浊液、胶体、溶液 | C. | 胶体、浊液、溶液 | D. | 浊液、溶液、胶体 |
7.下列叙述中,错误的是( )
| A. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| B. | 实验室制取氯气时,常用饱和石灰水来吸收多余的氯气 | |
| C. | 漂白粉在漂白时产生次氯酸,所以漂白粉能使燃料等有机色素褪色 | |
| D. | 钾元素颜色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧置无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 |
17.下列实验操作中正确的是( )
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10mL量筒量取8.58mL蒸馏水 | |
| C. | 制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
4.下列关于气体摩尔体积的几种说法正确的是( )
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 非标准状况下,1mol任何气体不可能占有22.4L体积 | |
| C. | 0.4.molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L | |
| D. | 同温、同压下,相同质量的CO和CO2具有相同的体积 |
1.下列各图所示的实验原理、方法、装置或操作,其中正确的是( )
| A. |  向容量瓶中转移溶液 | B. |  中和热的测定 | ||
| C. | 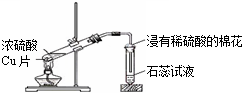 浓硫酸与铜的反应 | D. |  乙二酸晶体受热分解 |
2.下列过程中,属于非自发过程的是( )
| A. | N2和O2混合 | B. | 常温、常压下,石墨转化为金刚石 | ||
| C. | H2和O2化合生成H2O | D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |