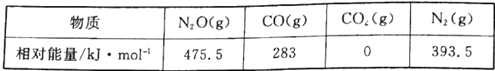
题目内容
【题目】设![]() 为阿伏加德罗常数的值,下列叙述一定正确的是
为阿伏加德罗常数的值,下列叙述一定正确的是![]()
![]()
A.在![]() 数目为
数目为![]() 的
的![]() 溶液中,
溶液中,![]() 总数为
总数为![]()
B.![]() 稀硝酸与Fe完全反应
稀硝酸与Fe完全反应![]() 还原产物只有
还原产物只有![]() ,转移电子的数目为
,转移电子的数目为![]()
C.![]() 与
与![]() 在催化剂的作用下加热充分反应,所得NO的分子数为
在催化剂的作用下加热充分反应,所得NO的分子数为![]()
D.![]() 的硫酸溶液中含有
的硫酸溶液中含有![]() 的数目为
的数目为![]()
【答案】B
【解析】
A.![]() 在溶液中会水解,导致个数减少,故当溶液中的
在溶液中会水解,导致个数减少,故当溶液中的![]() 总数为
总数为![]() 时,
时,![]() 溶液中
溶液中![]() 总数多于
总数多于![]() ,故A错误;
,故A错误;
B.400mL![]() 稀硝酸物质的量
稀硝酸物质的量![]() ,生成硝酸亚铁
,生成硝酸亚铁![]() ,生成硝酸铁,
,生成硝酸铁,![]() ,每反应
,每反应![]() 电子转移3mol,
电子转移3mol,![]() 稀硝酸与Fe完全反应
稀硝酸与Fe完全反应![]() 还原产物只有
还原产物只有![]() ,转移电子的数目为
,转移电子的数目为![]() ,故B正确;
,故B正确;
C.依据方程式![]() ,知
,知![]() 与
与![]() 反应,氧气有剩余,NO易与氧气反应,故所得的NO分子数要少于
反应,氧气有剩余,NO易与氧气反应,故所得的NO分子数要少于![]() ,故C错误;
,故C错误;
D.![]() 的硫酸溶液,没有指明溶液的体积无法计算溶液中
的硫酸溶液,没有指明溶液的体积无法计算溶液中![]() 的数目,故D错误。
的数目,故D错误。
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组设计实验制备苯甲酸异丙酯,其原理为
![]() ,用如图所示装置进行实验:
,用如图所示装置进行实验:

物质的部分物理性质如表所示:
物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水溶性 |
苯甲酸 | 122 | 1.27 | 249 | 微溶 |
异丙醇 | 60 | 0.79 | 82 | 易溶 |
苯甲酸异丙酯 | 164 | 1.17 | 218 | 不溶 |
实验步骤:
步骤Ⅰ.在干燥的仪器a中加入38.1g苯甲酸、30mL异丙醇和15mL浓硫酸,再加入几粒沸石;
步骤Ⅱ.加热至70℃左右,保持恒温半小时;
步骤Ⅲ.将仪器a中液体进行如下所示操作得到粗产品:

步骤Ⅳ.将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤Ⅰ中加入三种试剂的先后顺序一定错误的是___(填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为___。加入的苯甲酸和异丙醇中,一般使异丙醇稍过量,目的是___。
(3)本实验一般采用水浴加热,因为温度过高会使产率___(填“增大”“减小”或“不变”)。
(4)步骤III的操作Ⅰ中第二次水洗的目的是__,操作Ⅱ中加入无水硫酸镁的作用为___。
(5)步骤Ⅳ操作时应收集218℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为___(填物质名称)。
(6)如果得到的苯甲酸异丙酯的质量为40.930g,则该实验的产率为___%(结果保留2位有效数字)。