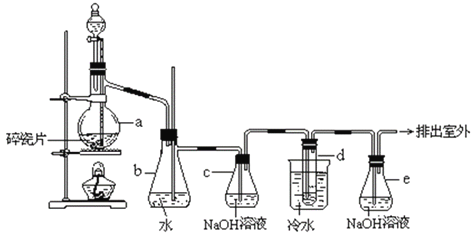
题目内容
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PI3)引用作新敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成。回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H1。
CH3NH2(g)+H2O(g) △H1。
①NH3电子式为_______。
②已知该反应中相关化学键的键能数据如下:

则该反应的△H1=_______kJ·mol-1
(2)上述反应中所需的甲醇可以利用甲烷为原料在催化剂作用下直接氧化来合成。煤炭中加氢气可发生反应:C(s)+2H2(g)![]() CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。

①该反应的△H2_______0(填“>” 、“<”或“=”),判断理由是_______。
②在4MPa、1100K时,图中X点v正(H2)____ v逆(H2)(填“>”、“<”或“=”)。该条件下,将1molC和2molH2通入密闭容器中进行反应,平衡时测得的转化率为80%,CH4的体积分数为______。若维持容器体积不变,向其中再加入0.5mo1C和1mo1H2,再次达到平衡后,平衡常数K_____(填“增大”、“减小”或“不变”)。
③某化学兴趣小组提供下列四个条件进行上述反应,比较分析后,你选择的反应条件是______(填字母序号)。
A.5MPa 800K B.6MPa 1000K C.10MPa 1000K D.10MPa 1100K
(3)已知常温下PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,Pb(NO3)2溶液与KI溶液混合可形成PbI2沉淀。现将浓度为2×10-3mol·L-1的Pb(NO3)2溶液与一定浓度的KI溶液等体积混合,则生成沉淀所需KI溶液的最小浓度为______。
【答案】![]() —12 > 随着温度升高,碳的平衡转化率增大,平衡向正反应方向移动,故该反应为吸热反应 > 66.7% 不变 B 4×10-3mol·L-1
—12 > 随着温度升高,碳的平衡转化率增大,平衡向正反应方向移动,故该反应为吸热反应 > 66.7% 不变 B 4×10-3mol·L-1
【解析】
(1)①NH3为共价化合物;
②由反应热=反应物总键能-生成物总键能可得;
②在4MPa、1100K时,图中X点没有达到平衡,碳的转化率有增大趋势,说明反应向正反应方向进行;由题给数据建立三段式求解;
③由图可知条件为6MPa 1000K时,碳的转化率高于5MPa 800K,与10MPa 1000K和10MPa 1100K相差不大;
(3)由常温下PbI2饱和溶液中c(Pb2+)计算溶度积,再由c(Pb2+)和溶度积计算所需KI溶液的最小浓度。
(1)①NH3为共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②由反应热=反应物总键能-生成物总键能可得△H1=[3E(C—H)+E(C—O)+ E(H—O)+3 E(N—H)]—[3E(C—H)+E(C—N)+2E(N—H)+2E(H—O)]= E(C—O)—E(H—O)+E(N—H)—E(C—N)=(351—463+393—293)kJ·mol-1=—12kJ·mol-1,故答案为:—12;
(2)①由图可知,随着反应温度升高,碳的平衡转化率增大,说明平衡向正反应方向移动,该反应为吸热反应,故答案为:>;随着温度升高,碳的平衡转化率增大,平衡向正反应方向移动,故该反应为吸热反应;
②在4MPa、1100K时,图中X点没有达到平衡,碳的转化率有增大趋势,说明反应向正反应方向进行,则v正(H2) > v逆(H2);由题给数据建立如下三段式:
C(s)+2H2(g)![]() CH4(g)
CH4(g)
起(mol) 1 2 0
变(mol) 0.8 1.6 0.8
平(mol) 0.4 0.8
由三段式可得CH4的体积分数为![]() ;温度不变,平衡常数不变,故答案为:>;66.7%;不变;
;温度不变,平衡常数不变,故答案为:>;66.7%;不变;
③由图可知条件为6MPa 1000K时,碳的转化率高于5MPa 800K,与10MPa 1000K和10MPa 1100K相差不大,从节约能源的角度考虑6MPa 1000K是较好的选择,故答案为:B;
(3)由常温下PbI2饱和溶液中c(Pb2+)=1.0×10-3mol·L-1可知,Ksp(PbI2)=c(Pb2+)c2(I-)=1.0×10-3molL-1×(2.0×10-3mol/L)2=4×10-9,则现将浓度为2×10-3mol·L-1的Pb(NO3)2溶液与一定浓度的KI溶液等体积混合后c(Pb2+)为1×10-3mol·L-1,溶液中c(I-)=![]() =2×10-3mol·L-1,则所需KI溶液的最小浓度为2×10-3mol·L-1×2=4×10-3mol·L-1,故答案为:4×10-3mol·L-1。
=2×10-3mol·L-1,则所需KI溶液的最小浓度为2×10-3mol·L-1×2=4×10-3mol·L-1,故答案为:4×10-3mol·L-1。

【题目】五氧化二钒及其他钒的化合物广泛应用于钢铁、有色合金、化工、炼油、玻璃及陶瓷等工业部门。可从含钒石煤灰渣中提钒,该试验工艺流程如下图:

表1 灰渣主要化学成分分析/%
V2O3 | SiO2 | Fe2O3 | Al2O3 | MgO | K2O | CaO | 烧失量 |
1.26 | 55.71 | 6.34 | 7.54 | 1.26 | 3.19 | 1.41 | 20.55 |
表2中间盐主要成分分析/%(以氧化物形式表示其含量)
V2O3 | Al2O3 | Fe2O3 | MgO | K2O |
5.92 | 1.70 | 18.63 | 2.11 | 3.38 |
已知:
①石煤灰渣的化学成分分析见表1,中间盐的主要成分分析见表2。
②矿物焙烧过程中,若温度过高,易发生烧结,温度越高,烧结现象越严重。
③萃取反应可以表示为:VO2++(HR2)PO4(o)→VO[R2PO4]R(o)+H+,(o)表示有机相
④有机萃取剂(HR2)PO4萃取VO2+的能力比萃取V02+要强。
请回答:
(1)提高浸取率的方法有____________,残渣的主要成分为______________________,
(2)经几级萃取后,有时候要适当加酸调整pH值,结合萃取反应方程式,说明原因_____________。反萃取操作应加入_____________试剂。
(3)中间盐溶解过程中,加铁粉的主要目的是_____________________。
(4)石煤中的钒以V(Ⅲ)为主,有部分V(Ⅳ),很少见V(Ⅴ)。如图1和如图2分别为焙烧温度和焙烧时间对钒浸出率的影响,由如图2可得最佳焙烧时间为______________h,由如图1可得最佳焙烧温度为800-850℃之间,焙烧温度在850℃以下时,钒浸出率随焙烧温度的上升几乎直线上升的原因是_________________________,当焙烧温度高超过850℃以后,再提高温度,浸出率反而下降的可能原因是:_________________________。

(5)反萃取液中的VO2+,加入氯酸钠后被氧化为VO2+,请写出该反应的离子方程式______________。然后用氨水调节pH到1.9~2.2沉钒,得多钒酸铵沉淀(化学式为(NH4)2V12O31·nH2O),再经固液分离、干燥、焙烧得五氧化二钒产品,请写出此步反应的化学方程式____________________________。