题目内容
【题目】常温下,下列有关叙述正确的是![]()
A.饱和氯水中滴加NaOH至溶液呈中性:![]()
B.100mL![]() 的
的![]() 溶液和200
溶液和200![]() 的
的![]() 溶液所含的
溶液所含的![]() 相同
相同
C.![]() 的一元酸和
的一元酸和![]() 的一元强碱等体积混合后的溶液;
的一元强碱等体积混合后的溶液;![]()
D.常温下,![]() 、浓度均为
、浓度均为![]() 。
。![]() 的
的![]() 、
、![]() COONa混合溶液
COONa混合溶液![]()
![]()
【答案】A
【解析】
A.溶液呈中性,则![]() ,根据电荷守恒
,根据电荷守恒![]() 可知:
可知:![]() ,根据物料守恒得:
,根据物料守恒得:![]() ,二者结合可得:
,二者结合可得:![]() ,故A正确;
,故A正确;
B.100ml![]() 的
的![]() 溶液和200ml
溶液和200ml![]() 的
的![]() 溶液中含有溶质的物质的量都是
溶液中含有溶质的物质的量都是![]() ,由于两溶液中铵根离子浓度不同,则铵根离子的水解程度,不同,所以两溶液所含
,由于两溶液中铵根离子浓度不同,则铵根离子的水解程度,不同,所以两溶液所含![]() 不相同,故B错误;
不相同,故B错误;
C.![]() 的一元酸和
的一元酸和![]() 的一元强碱等体积混合,若酸为强酸,则混合液中:
的一元强碱等体积混合,若酸为强酸,则混合液中:![]() ,若为弱酸,则混合液中酸过量:
,若为弱酸,则混合液中酸过量:![]() ,所以混合液中正确的浓度关系为:
,所以混合液中正确的浓度关系为:![]() ,故C错误;
,故C错误;
D.![]() 浓度均为
浓度均为![]() 的
的![]() 、
、![]() 混合溶液,说明醋酸的电离程度大于
混合溶液,说明醋酸的电离程度大于![]() 的水解程度,则:
的水解程度,则:![]() ,根据电荷守恒
,根据电荷守恒![]() 可知:
可知:![]() ,故D错误;
,故D错误;
故答案为A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
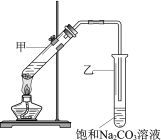
小学生10分钟应用题系列答案【题目】某化学兴趣小组设计实验制备苯甲酸异丙酯,其原理为
![]() ,用如图所示装置进行实验:
,用如图所示装置进行实验:

物质的部分物理性质如表所示:
物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水溶性 |
苯甲酸 | 122 | 1.27 | 249 | 微溶 |
异丙醇 | 60 | 0.79 | 82 | 易溶 |
苯甲酸异丙酯 | 164 | 1.17 | 218 | 不溶 |
实验步骤:
步骤Ⅰ.在干燥的仪器a中加入38.1g苯甲酸、30mL异丙醇和15mL浓硫酸,再加入几粒沸石;
步骤Ⅱ.加热至70℃左右,保持恒温半小时;
步骤Ⅲ.将仪器a中液体进行如下所示操作得到粗产品:

步骤Ⅳ.将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤Ⅰ中加入三种试剂的先后顺序一定错误的是___(填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为___。加入的苯甲酸和异丙醇中,一般使异丙醇稍过量,目的是___。
(3)本实验一般采用水浴加热,因为温度过高会使产率___(填“增大”“减小”或“不变”)。
(4)步骤III的操作Ⅰ中第二次水洗的目的是__,操作Ⅱ中加入无水硫酸镁的作用为___。
(5)步骤Ⅳ操作时应收集218℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为___(填物质名称)。
(6)如果得到的苯甲酸异丙酯的质量为40.930g,则该实验的产率为___%(结果保留2位有效数字)。
【题目】某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是
离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是
步骤 | 操作 | 现象 |
| 用pH试纸检验 | 溶液的pH大于7 |
| 向溶液中滴加氯水,再加入 |
|
| 向 | 有白色沉淀产生 |
| 过滤,向滤液中加入 | 有白色沉淀产生 |
A.肯定含有离子的![]() 、
、![]() 、
、![]()
B.肯定没有的离子是![]() 、
、![]()
C.可能含有的离子是![]() 、
、![]() 、
、![]()
D.不能确定的离子是![]() 、
、![]() 、
、![]()