题目内容
【题目】下列除去杂质的实验方法正确的是
A. 除去乙酸乙酯中的少量乙酸:加入KOH溶液,充分反应后,弃去水溶液
B. 除去苯酚中的少量甲苯:加入酸性高锰酸钾溶液,充分反应后,弃去水溶液
C. 除去苯中少量的甲苯:加高锰酸钾溶液,振荡,分液
D. 除去乙醇中少量的水:加足量生石灰,蒸馏
【答案】D
【解析】
A.乙酸乙酯与KOH溶液能反应,除去乙酸乙酯中的少量乙酸应该加入饱和碳酸钠溶液,故A错误;
B.苯酚和甲苯均能被酸性高锰酸钾溶液氧化,故B错误;
C.酸性高锰酸钾溶液能把甲苯氧化成苯甲酸,酸性高锰酸钾溶液与苯不反应,但苯甲酸与苯互溶,故C错误;
D.乙醇和水的沸点不同,水可与生石灰反应,用蒸馏的方法分离,故D正确。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】乙二醛(OHC-CHO)化学性质活泼,是纺织工业中常用的一种有机原料,能增加棉花、尼龙等纤维的防缩性和防皱性。其工业生产方法主要是乙二醇(HOCH2CH2OH)气相催化氧化法和乙醛液相硝酸氧化法。请回答下列相关问题:
(1)乙二醇气相催化氧化法
以乙二醇、氧气为原料,在催化剂存在的条件下,250℃左右开始缓慢进行,生成乙二醛和副产物乙醇酸[CH2(OH)COOH]的反应方程式:
I.HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)△H1
OHC-CHO(g)+2H2O(g)△H1
II.HOCH2CH2OH(g)+O2(g) ![]() CH2(OH)COOH(g)+H2O(g)△H2
CH2(OH)COOH(g)+H2O(g)△H2
已知反应I中相关化学键键能数据如下:
化学键 | C-H | C-O | H-O | O==O | C==O | C-C |
E/kJ·mol-1 | 413 | 343 | 465 | 498 | 728 | 332 |
①△H1=_____kJ/mol,反应I的化学平衡常数表达式为K=________。
②欲提高I的平衡产率,可以采取的措施是______(填标号)。
A.升高温度 B.增大压强 C.降低温度 D.减小压强
③提高乙二醛反应选择性的关键因素是_________________________。
④保持温度和容积不变,下列描述能说明反应I达到平衡状态的是________(填标号)。
A.v正(O2)=2v逆(H2O)
B.混合气体的压强不再随时间变化而变化
C.混合气体的密度不再发生变化
D.乙二醇与OHC-CHO的物质的量之比为1:1
E.混合气体中乙二醛的体积分数不再发生变化
(2)乙醛(CH3CHO)液相硝酸氧化法
11.0g40%的乙醛溶液和40%的硝酸,按一定比例投入氧化反应釜内,在Cu(NO3)2催化下,控制温度在38~40℃时,反应10h,再通过萃取等操作除去乙醛、硝酸等,最后经减压浓缩得4.35g40%乙二醛溶液。
①用稀硝酸氧化乙醛制取乙二醛时,有N2O产生。其化学方程式为______________________。
②利用上面数据,计算乙二醛的产率为___________________________。
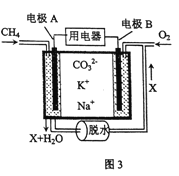
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
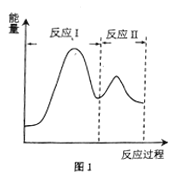
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
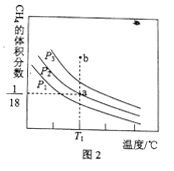
① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。