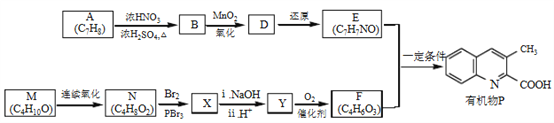
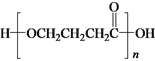题目内容
【题目】向0. 10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=![]() ]与混合液pH的关系如图所示。下列说法正确的是
]与混合液pH的关系如图所示。下列说法正确的是
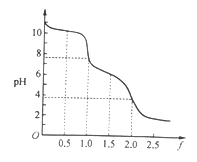
A. f=0时,溶液中:c(Na+)=2c(CO32-)
B. f=0.5时,溶液中:c(HCO3-)>c(CO32-)
C. f= 1时,溶液中:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-)+c(OH-)
D. f=2时,溶液中:1/2c(Na+)=c(CO32-)+c( HCO3-)+c(H2CO3)
【答案】B
【解析】A.f=0时,溶液为Na2CO3,因水解,则溶液中c(Na+)>2c(CO32-),故A错误;B.f=0.5时,溶液中NaHCO3和Na2CO3等物质的量,因CO32-的水解程度大于HCO3-,则溶液中c(HCO3-)>c(CO32-),故B正确;C.f= 1时,溶液中的溶质为NaHCO3、Na2CO3和NaCl,根据电荷守恒定律可知:c (Na+) + c (H+) = 2c(CO32-) + c(HCO3-)+c(OH-)+c(Cl-),故C错误;D.f=2时,Na2CO3恰好和HCl反应,有少量CO2逸出,溶液中: ![]() c(Na+)>c(CO32-)+c( HCO3-)+c(H2CO3),故D错误;答案为B。
c(Na+)>c(CO32-)+c( HCO3-)+c(H2CO3),故D错误;答案为B。

【题目】某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是___________。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
② | 在FeCl2溶液中加入锌片 |
| Zn+Fe2+=Zn2++Fe | |
③ | 在FeCl3溶液中加入足量铁粉 |
| Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
④ |
|
| Fe3+具有氧化性 |
实验结论:_________________________________。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:_____。(填序号)
A、Cl2 B、Na C、Na+ D、Cl- E、SO2 F、盐酸