题目内容
3.(1)一定质量的铁与含1molHNO3的稀硝酸恰好完全反应,稀硝酸的还原产物是NO.①生成的NO在标况下的体积是:5.6 L.
②设一定质量的铁为mg,则m的范围是:14≤m≤21.
③将反应结束后的溶液加水稀释到500mL,该溶液中c(NO3-)=1.5mol/L.
(2)为了探究某Cu,CuO,Cu2O混合物的组成情况,向混合物中加入100mL 0.6mol/L的硝酸溶液,恰好使其溶解,同时收集到224mLNO(标况)
①写出Cu2O与稀硝酸反应的化学方程式:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
②产物中Cu(NO3)2的物质的量:0.025mol
③若混合物中含铜0.01mol,则n(Cu2O)=0.005 mol.
分析 (1)铁与稀硝酸反应当硝酸过量时为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,当铁过量时为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
①氧化性硝酸占硝酸总量的$\frac{1}{4}$;
②用极端假设法解题;
③将反应结束后的溶液加水稀释到500mL,酸性的硝酸根离子应等于总的硝酸减去氧化性的硝酸;
(2)①硝酸具有强氧化性,将Cu2O氧化生成硝酸铜、一氧化氮和水,配平据此写出反应方程式;
②利用N原子守恒进行计算;
③利用N原子守恒、电子守恒和铜原子守恒进行计算.
解答 解:(1)①铁与稀硝酸反应当硝酸过量时为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O…①,当铁过量时为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O…②,由可知不论发生反应①还是反应②,氧化性的硝酸占硝酸的$\frac{1}{4}$,所以生成的NO在标况下的体积是$\frac{1}{4}$×1mol×22.4L/mol=5.6L,故答案为:5.6;
②如果按反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O进行反应,消耗的铁是0.25mol,所以质量为:0.25mol×56g/mol=14g,如果按反应3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O进行反应,消耗的铁是$\frac{3×0.25mol}{2}$=0.375mol,所以质量为:0.375mol×56g/mol=21g,故答案为:14≤m≤21;
③将反应结束后的溶液加水稀释到500mL,该溶液中c(NO3-)=$\frac{1-0.25}{0.5}$=1.5mol/L,故答案为:1.5mol/L;
(2)①硝酸具有强氧化性,将Cu2O氧化生成硝酸铜、一氧化氮和水,反应方程式为3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
(2)n(HNO3)=0.1L×0.6mol/L=0.06mol,n(NO)=$\frac{0.224L}{22.4L/mol}$=0.01mol,
利用N原子守恒可知n[Cu(NO3)2]=$\frac{0.06mol-0.01mol}{2}$=0.025mol,
故答案为:0.025mol;
(3)由Cu元素守恒可得:2×n(Cu20)+n(CuO)+0.01mol=0.025mol,
由氧化还原反应得失电子守恒可知:0.01×2+2×n(Cu20)=$\frac{0.224L}{22.4L/mol}$×3,
解之得:n(Cu20)=0.005mol,n(CuO)=0.005mol,
故答案为:0.005.
点评 本题考查混合物的计算,题目具有一定难度,注意从质量守恒和氧化还原反应得失电子守恒的角度分析.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案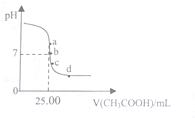 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )| A. | a点:c(CH3COONa)=0.1000 mol•L-1 | B. | b点:c(CH3COONa)=c(CH3COOH) | ||
| C. | c点:c(H+)=c(CH3COO-)+c(CH3COOH) | D. | d点:c(Na+)<c(CH3COO-)+c(CH3COOH) |
| A. | 乙醇(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
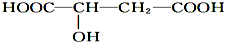 下列相关说法正确的是( )
下列相关说法正确的是( )| A. | 苹果酸在一定条件下能催化氧化生成醛 | |
| B. | 苹果酸在一定条件下能发生取代和消去反应 | |
| C. | 苹果酸在一定条件下能发生加聚反应生成高分子化合物 | |
| D. | 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3 |
| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入澄清石灰水中制漂白粉 | D. | 高温分解石灰石制生石灰 |
一定条件下,通过下列反应可以制备特种陶瓷的原料M gO: MgSO4(s)+ CO(g)  MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
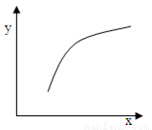
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
 Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
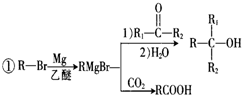
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应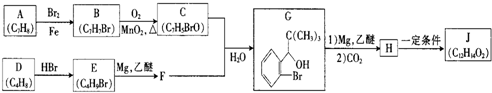
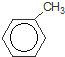 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$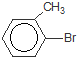 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应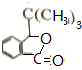
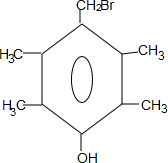 .
.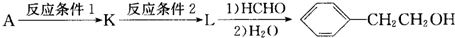
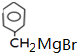 .
.