题目内容
8.合乎实际并用于工业生产的是( )| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入澄清石灰水中制漂白粉 | D. | 高温分解石灰石制生石灰 |
分析 A.钠比氯化钠贵;
B.氢气与氯气在光照条件下发生爆炸;
C.澄清的石灰水中含有的氢氧化钙的量少;
D.石灰石高温分解可生成生石灰.
解答 解:A.钠比氯化钠贵,用钠制备氯化钠,成本太高不合乎实际,故A错误;
B.氢气与氯气在光照条件下发生爆炸,不能用来制备氯化氢,工业上用氢气在氯气中点燃的方法制备氯化氢故B错误;
C.澄清的石灰水中含有的氢氧化钙的量少,工业制漂白粉是用氯气与石灰乳反应制得,故C错误;
D.工业制生石灰是用石灰石高温分解,故D正确;
故选:D.
点评 本题考查了工业制备氯化钠、氯化氢、漂白粉、生石灰的反应原理,明确物质的性质和反应的条件是解题关键,注意应符合实际,符合经济效应原则.

练习册系列答案
相关题目
13.根据碱金属的性质变化规律可推测铯的性质,下列推测错误的是( )
| A. | 灼烧CsCl时,火焰有特殊的颜色 | |
| B. | CsNO3易溶于水 | |
| C. | 在钠、钾、铯三种单质中,钠的熔点最低 | |
| D. | CsOH是弱碱 |
20.运用相关化学知识进行判断,下列结论错误的是( )
| A. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 某吸热反应能自发进行,因此该反应是熵增反应 |
17.下列离子方程式书写正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠和水的反应:Na+2H2O=H2↑+Na++2OH- | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+=Al3++3H2O | |
| D. | Ba(OH)2溶液中加入稀H2SO4:Ba2++SO42-=BaSO4↓ |
15.质量数为37的原子,应该有( )
| A. | 18个质子,19中子,19电子 | B. | 18个质子,20个中子,18个电子 | ||
| C. | 19个质子,18个中子,20个电子 | D. | 18个质子,19个中子,18个电子 |
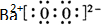 (写电子式),
(写电子式),
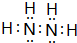 ,六个原子处在同一平面吗?否(是?否?).
,六个原子处在同一平面吗?否(是?否?).