题目内容
18.某研究小组为了探究固体甲(二元化合物)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验: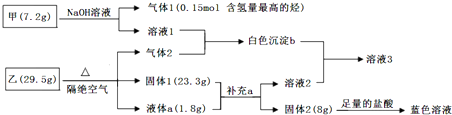
已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解.请回答下列问题:
(1)甲的化学式Al4C3,气体1的电子式
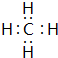
(2)加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,该反应的化学方程式为4CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+CO2+2H2O或8CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu2O+CO2+2H2O或3CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+CO+2H2O或6CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2O+CO+2H2O.
(3)乙的化学式BaCO3•Cu(OH)2或BaCu(OH)2CO3.
(4)足量气体2与溶液1反应的离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
分析 甲和NaOH溶液反应生成气体1,气体1是含氢量最高的烃,为CH4,根据元素守恒知甲中含有C元素,甲烷的物质的量为0.15mol,根据C原子守恒得m(C)=0.15mol×12g/mol=1.8g,甲是二元化合物,另一种元素质量为7.2g-1.8g=5.4g,向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解,则溶液1为偏铝酸盐,根据元素守恒知,溶液1为NaAlO2,则n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,C、Al原子个数之比=0.15mol:0.2mol=3:4,则甲为Al4C3;
偏铝酸钠和气体2反应生成白色沉淀b为Al(OH)3,气体2为酸性气体;
固体2和稀盐酸反应生成蓝色溶液,固体2中含有Cu元素;固体1和溶液a混合得到溶液2和固体2,溶液2能溶解氢氧化铝,向溶液2中连续通入气体2,先产生白色沉淀,后沉淀溶解,则溶液2为强碱溶液,溶液2只能是Ba(OH)2;固体1和液体a混合得到溶液2,则a为H2O,且固体1中含有BaO,固体1为氧化物,所以还含有CuO;
根据质量守恒得气体2质量=29.5g-1.8g-23.3g=4.4g,且气体2为无色无味气体,向氢氧化钡溶液中通入气体2,先生成白色沉淀后白色沉淀溶解,则气体2为CO2,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(CuO)=$\frac{8g}{80g/mol}$=0.1mol、n(BaO)=$\frac{23.3g-8g}{153g/mol}$=0.1mol,n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,
乙中Ba、Cu、H、O、C原子个数之比=n(BaO):n(CuO):2n(H2O):[2n(CO2)+n(BaO)+n(CuO)+n(H2O)]:n(CO2)=0.1mol:0.1mol:0.2mol:0.5mol:0.1mol=1:1:2:5:1,其化学式为BaCO3•Cu(OH)2或BaCu(OH)2CO3,以此来解答.
解答 解:甲和NaOH溶液反应生成气体1,气体1是含氢量最高的烃,为CH4,根据元素守恒知甲中含有C元素,甲烷的物质的量为0.15mol,根据C原子守恒得m(C)=0.15mol×12g/mol=1.8g,甲是二元化合物,另一种元素质量为7.2g-1.8g=5.4g,向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解,则溶液1为偏铝酸盐,根据元素守恒知,溶液1为NaAlO2,则n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,C、Al原子个数之比=0.15mol:0.2mol=3:4,则甲为Al4C3;
偏铝酸钠和气体2反应生成白色沉淀b为Al(OH)3,气体2为酸性气体;
固体2和稀盐酸反应生成蓝色溶液,固体2中含有Cu元素;固体1和溶液a混合得到溶液2和固体2,溶液2能溶解氢氧化铝,向溶液2中连续通入气体2,先产生白色沉淀,后沉淀溶解,则溶液2为强碱溶液,溶液2只能是Ba(OH)2;固体1和液体a混合得到溶液2,则a为H2O,且固体1中含有BaO,固体1为氧化物,所以还含有CuO;
根据质量守恒得气体2质量=29.5g-1.8g-23.3g=4.4g,且气体2为无色无味气体,向氢氧化钡溶液中通入气体2,先生成白色沉淀后白色沉淀溶解,则气体2为CO2,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(CuO)=$\frac{8g}{80g/mol}$=0.1mol、n(BaO)=$\frac{23.3g-8g}{153g/mol}$=0.1mol,n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,
乙中Ba、Cu、H、O、C原子个数之比=n(BaO):n(CuO):2n(H2O):[2n(CO2)+n(BaO)+n(CuO)+n(H2O)]:n(CO2)=0.1mol:0.1mol:0.2mol:0.5mol:0.1mol=1:1:2:5:1,其化学式为BaCO3•Cu(OH)2或BaCu(OH)2CO3,
(1)通过以上分析知,甲为Al4C3,气体1是甲烷,电子式为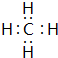 ,故答案为:Al4C3;
,故答案为:Al4C3;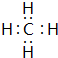 ;
;
(2)气体1是甲烷、固体2是CuO,加热条件下,气体1与固体2反应,可产生另外一种气体和一种固体,生成的气体应该是二氧化碳或CO、固体是Cu或Cu2O,根据元素守恒知还应该生成水,所以该反应的化学方程式为4CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+CO2+2H2O或8CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu2O+CO2+2H2O或3CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+CO+2H2O或 6CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2O+CO+2H2O,
故答案为:4CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+CO2+2H2O或8CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu2O+CO2+2H2O或3CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+CO+2H2O或 6CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2O+CO+2H2O;
(3)通过以上分析知,乙为BaCO3•Cu(OH)2或BaCu(OH)2CO3,故答案为:BaCO3•Cu(OH)2或BaCu(OH)2CO3;
(4)气体2是二氧化碳、溶液1为偏铝酸钠,足量二氧化碳和偏铝酸钠反应生成氢氧化铝和碳酸氢钠,离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查物质组成及无机物推断,为高频考点,涉及铝、Cu、Ba元素及其化合物知识,把握偏铝酸盐性质是解本题关键,结合原子守恒确定物质化学式,题目难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.2NA | |
| B. | 1.2gNaHSO4固体中含有的阳离子数目为0.02NA | |
| C. | Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.2NA | |
| D. | 4.6 g NO2和N2O4混合物中含有的原子总数为0.3NA |
| A. | 若B(OH)m 是强碱,则A(OH)m一定为强碱 | |
| B. | 若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 | |
| C. | 若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属 | |
| D. | 若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性 |
| A. | 硫酸型酸雨的形成会涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | 工业上制取粗硅的化学方程式SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ClO?+2H+=Cl2↑+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
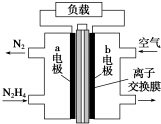 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液.下列关于该电池的叙述错误的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液.下列关于该电池的叙述错误的是( )| A. | b极发生还原反应 | |
| B. | a极的反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 放电时,电流从b极经过负载流向a极 | |
| D. | 其中的离子交换膜需选用阴离子交换膜 |
| A. | CH2=CH-CH2-CH3 | B. | CH2=CH2 | C. | CH3-CH=CH-CH3 | D. | 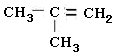 |