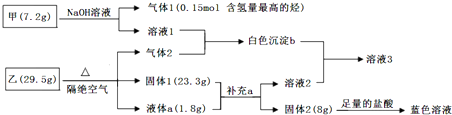
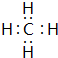题目内容
8.在一个容积为3L的密闭容器里进行如下反应:2SO2(g)+O2(g)═2SO3(g),反应开始时向容器内加入2mol SO2和1.6mol O2,2min末反应达到平衡,此时n(O2)=0.7mol.求:(1)前2min内O2的平均反应速率;
(2)2min末SO3的浓度;
(3)平衡时SO2的转化率.
分析 在一个容积为3L的密闭容器里,反应开始加入2mol SO2和1.6mol O2,2min末反应达到平衡,此时n(O2)=0.7mol,则:
2SO2(g)+O2(g)═2SO3(g)
起始量(mol):2 1.6 0
变化量(mol):1.8 0.9 1.8
平衡量(mol):0.2 0.7 1.8
(1)根据v=$\frac{△c}{△t}$计算v(O2);
(2)根据v=$\frac{n}{V}$计算;
(3)二氧化硫转化率=$\frac{消耗二氧化硫物质的量}{二氧化硫起始物质的量}$×100%.
解答 解:在一个容积为3L的密闭容器里,反应开始加入2mol SO2和1.6mol O2,2min末反应达到平衡,此时n(O2)=0.7mol,则:
2SO2(g)+O2(g)═2SO3(g)
起始量(mol):2 1.6 0
变化量(mol):1.8 0.9 1.8
平衡量(mol):0.2 0.7 1.8
(1)v(O2)=$\frac{\frac{0.9mol}{3L}}{2min}$=0.15 mol/(L?min),
答:前2min内O2的平均反应速率为0.15 mol/(L?min);
(2)2min末c(SO3)=$\frac{1.8mol}{3L}$=0.6mol/L,
答:2min末SO3的浓度为0.6mol/L;
(3)平衡时SO2转化率=$\frac{1.8mol}{2mol}$×100%=90%,
答:平衡时SO2转化率90%.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意掌握三段式解题法在化学平衡计算中应用.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$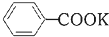 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O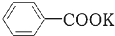 +HCl→
+HCl→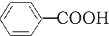 +KCl
+KCl反应试剂、产物的物理常数:
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
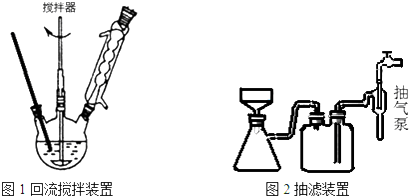
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
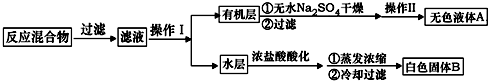
(1)无色液体A的结构简式为
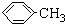 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
| A. | 常温下,4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则该反应的△H<0 | |
| B. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 | |
| C. | 锌与稀硫酸反应时加少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 | |
| D. | 甲基苯环上的一个氢原子被含3个碳原子的烷基取代的产物可能有3种 |
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
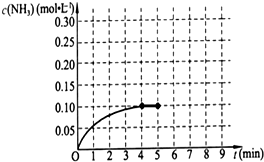 已知工业上合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
已知工业上合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示, (填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).