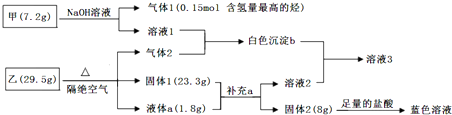
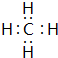题目内容
10.下列解释物质用途或现象的反应方程式不准确的是( )| A. | 硫酸型酸雨的形成会涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | 工业上制取粗硅的化学方程式SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ClO?+2H+=Cl2↑+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
分析 A.正常雨水溶解二氧化碳,硫酸型酸雨中溶解二氧化硫,酸性增强;
B.工业上制取粗硅,二氧化硅和碳反应生成硅和一氧化碳;
C.成分为盐酸的洁厕灵与84消毒液(NaClO)混合,发生氧化还原反应生成氯气;
D.向Na2S2O3溶液中加入稀硫酸,反应生成硫单质和二氧化硫气体.
解答 解:A.正常雨水溶解二氧化碳,硫酸型酸雨中溶解二氧化硫,酸性增强,是因为二氧化硫被空气中的氧气氧化成硫酸,则硫酸型酸雨的形成会涉及反应为2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4,故A正确;
B.工业上制硅的反应方程式为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故B错误;
C.成分为盐酸的洁厕灵与84消毒液(NaClO)混合,发生氧化还原反应,离子反应为Cl-+ClO-+2H+═Cl2↑+H2O,故C正确;
D.硫代硫酸钠与稀硫酸反应生成硫单质和二氧化硫气体,反应的离子方程式为:S2O32-+2H+═SO2↑+S↓+H2O,故D正确;
故选B.
点评 本题考查物质的性质及离子反应,为高频考点,把握物质的性质及生活中的应用为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.芳香族羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$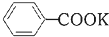 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
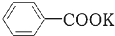 +HCl→
+HCl→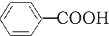 +KCl
+KCl
反应试剂、产物的物理常数:
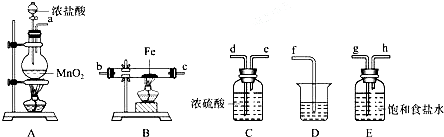
主要实验装置和流程如下:
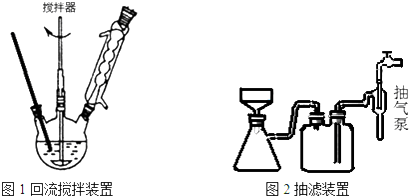
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
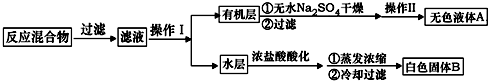
(1)无色液体A的结构简式为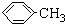 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$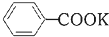 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O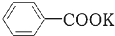 +HCl→
+HCl→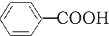 +KCl
+KCl反应试剂、产物的物理常数:
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

(1)无色液体A的结构简式为
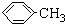 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
1.下列对氧化还原反应的分析中合理的是( )
| A. | Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂 | |
| B. | KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原 | |
| C. | 凡是氧化还原反应都能造福人类 | |
| D. | 在反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中H2O是还原剂 |
2.对于反应COCl2(g)?CO(g)+Cl2(g)△H=-QkJ•mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是
( )
( )
| A. | 一定条件下,该反应在任何温度下均能自发进行 | |
| B. | 反应CO(g)+Cl2(g)?COCl2(g)△H=+Q kJ•mol-1 化学平衡常数为K | |
| C. | 反应2COCl2(g)?2CO(g)+2Cl2(g) 化学平衡常数为2K | |
| D. | 将1mol COCl2 (g)置于一密闭容器中充分反应后放出QkJ的热量 |
19.NA 表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 22.4L CO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4L CH4与18g H2O所含有的电子数均为10 NA | |
| C. | 常温常压下,16g O2 与16gO3含有的分子数相同 | |
| D. | 0.1 mol/L K2SO4 溶液中含有 K+为0.2 NA |
20.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 反应H2(g)+I2(g)?2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |