题目内容
19.请从卤代烃、醇、酚、醛和羧酸中选择1~2个代表物,比较它们的化学性质.分析 卤代烃能在氢氧化钠的水溶液中发生取代反应生成醇类,在氢氧化钠的醇溶液中发生消去反应生成烯烃;
醇含有羟基,能与钠反应生成醇钠和氢气,与羧酸反应生成酯类,据此解答即可.
解答 解:卤代烃能在氢氧化钠的水溶液中发生取代反应生成醇类,在氢氧化钠的醇溶液中发生消去反应生成烯烃,以溴乙烷为例:CH3CH2Br+H2O$\stackrel{NaOH}{→}$CH3CH2OH+HBr,CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+H2O+NaBr;
醇含有羟基,能与钠反应生成醇钠和氢气,与羧酸反应生成酯类,以乙醇为例:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,乙醇与乙酸反应:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,乙醇也可以发生消去反应生成,
答:卤代烃、醇均能发生取代反应,氯代烃与醇也可发生消去反应,且乙醇能发生酯化反应.
点评 本题主要考查的是常见有机化合物的性质,掌握各自含有的官能团是解决本题的关键,注意有机化学反应类型的判断,难度不大.

练习册系列答案
相关题目
9.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 锂(Li)的密度比钠小,锂的熔沸点也比钠低 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
10.化学与生活是紧密相联的,下列说法正确的是( )
| A. | 地震灾区用漂白粉消毒,是利用漂白粉溶液的碱性 | |
| B. | 铝热反应是工业炼铁常用的方法 | |
| C. | 生铁在潮湿的空气中易生锈,其负极反应式为2H2O+02+4e-═4OH- | |
| D. | 实验室储存的钠着火时,可以用砂子盖灭 |
7.D是一种单质,化合物A、B、C都只含有两种元素,且A、B、D均含X元素.已知一定条件下可发生反应:A+B═C+D,由此可知X元素( )
| A. | 一定是金属元素 | |
| B. | 一定是非金属元素 | |
| C. | 可能是金属元素,也可能是非金属元素 | |
| D. | 以上均不正确 |
14.常温下,下列各组粒子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
3.2014年全国各地都遭遇了“十面埋伏”,二氧化硫、氮氧化物和可吸入颗粒是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化
①已知部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
汽车尾气进化中NO(g)和CO(g)发生反应的热化学方程式为2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-538kJ•mol-1
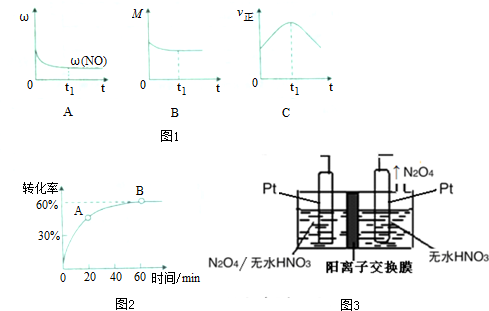
②若上述反应在绝热、恒荣的密闭体系中进行,并在t1时到达平衡状态,则下列示意图不符合题意的是C(填选项序号)(图中1ω、M、?、z分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO2,再合成硫酸,已知:
2SO${\;}_{{\;}_{2}}$(g)+O2(g)$?_{高温}^{催化剂}$2SO2(g)△H=-196.0kj/mol
①在一定温度的密闭容器中,SO2的转化率时间的变化关系如图2所示,则A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2)(填“大于”、“小于”或“等于”)
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同的是BC(填选项序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NO2也可以消除氮氧化物的污染,反应原理为:
NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cb)也可以表示平衡常数(记作Kp),则上述反应的K的表达式为$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$
(4)以N2O4为原料采用电解法可制备新型绿色硝化剂N2O3,实验装置如图3所示,电解池中生成N2O3的电极反应式为N2O4+2HNO3-e-=2N2O3+O2↑+2H+
(5)尾气中氢氧化物(NO和NO2)可用尿素[CO(NH2)3]溶液除去,反应生成对大气无污染的气体,1mol尿素能吸收工业尾气中氢氧化物(假设NO、NO2体积比为1:1)的质量为76g.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化
①已知部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
| 化学键 | N=O | C≡O | C=O | N≡N |
| 键能(kj/mol) | 632 | 1072 | 750 | 946 |
②若上述反应在绝热、恒荣的密闭体系中进行,并在t1时到达平衡状态,则下列示意图不符合题意的是C(填选项序号)(图中1ω、M、?、z分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO2,再合成硫酸,已知:
2SO${\;}_{{\;}_{2}}$(g)+O2(g)$?_{高温}^{催化剂}$2SO2(g)△H=-196.0kj/mol
①在一定温度的密闭容器中,SO2的转化率时间的变化关系如图2所示,则A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2)(填“大于”、“小于”或“等于”)
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同的是BC(填选项序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NO2也可以消除氮氧化物的污染,反应原理为:
NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cb)也可以表示平衡常数(记作Kp),则上述反应的K的表达式为$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$
(4)以N2O4为原料采用电解法可制备新型绿色硝化剂N2O3,实验装置如图3所示,电解池中生成N2O3的电极反应式为N2O4+2HNO3-e-=2N2O3+O2↑+2H+
(5)尾气中氢氧化物(NO和NO2)可用尿素[CO(NH2)3]溶液除去,反应生成对大气无污染的气体,1mol尿素能吸收工业尾气中氢氧化物(假设NO、NO2体积比为1:1)的质量为76g.

7.某无色溶液中只可能含有①Na+、②Ba2+、③Cl一、④Br一、⑤SO32一、⑥SO42一离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:步骤操作现象
(1)用pH试纸检验溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙红色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生
下列结论正确的是( )
(1)用pH试纸检验溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙红色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生
下列结论正确的是( )
| A. | 肯定含有的离子是③④⑤ | B. | 肯定没有的离子是②⑤ | ||
| C. | 可能含有的离子是①⑥ | D. | 不能确定的离子是③⑥ |
8.下列说法正确的是( )
| A. | 酸和醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | 实验证实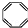 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为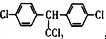 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. | 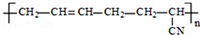 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |