题目内容
9.运用元素周期律分析下面的推断,其中错误的是( )| A. | 锂(Li)的密度比钠小,锂的熔沸点也比钠低 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
分析 A.碱金属从上到下,密度增大,熔沸点降低;
B.根据同主族元素的性质相似性分析;
C.根据同主族元素的性质的相似性和递变性分析;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强.
解答 解:A.碱金属从上到下,密度增大,熔沸点降低,则锂(Li)的密度比钠小,锂的熔沸点也比钠高,故A错误;
B.卤族元素的单质从上到下颜色逐渐加深,则砹(At)为有色固体,卤族元素单质的卤化银都不溶于水也不溶于硝酸,故B正确;
C.碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故C正确;
D.非金属性:Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则HBrO4的酸性比HIO4的酸性强,故D正确.
故选A.
点评 本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.

练习册系列答案
相关题目
19.下列各组气体通常条件下能稳定共存( )
| A. | NH3 O2 HCl | B. | H2S O2 SO2 | C. | CO2 HI Cl2 | D. | N2 H2 HCl |
17.短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素.下列说法不正确的是( )
| A. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y | |
| C. | W的氢化物熔沸点比Z的氢化物熔沸点低 | |
| D. | Y与R形成的化合物YR的熔点高、硬度大 |
4.下表给出14-17号元素的一些性质,请回答:
(1)它们所形成的氢化物中稳定性最差的是SiH4,还原性最差的是HCl.
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
1.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 加水稀释$\frac{c(O{H}^{-})}{c({H}^{+})}$增大的溶液:K+、Na+、SO42-、AlO2- | |
| B. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| C. | 铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3- | |
| D. | NaHCO3溶液:K+、Na+、SO42-、Al3+ |
18.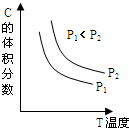 已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )
已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )
 已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )
已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )| A. | 正反应为吸热反应 | |
| B. | 100摄氏度时,当生成cmolC,放出E KJ热量 | |
| C. | a+b<c+d | |
| D. | 降低压强,正、逆反应速率都减小 |
 ;
; 或
或 ;
;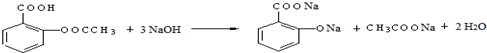 ;
;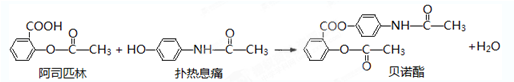 .
. ;
;