题目内容
14.常温下,下列各组粒子一定能在指定溶液中大量共存的是( )| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
分析 A.使酚酞变红色的溶液中存在大量氢氧根离子,铝离子与氢氧根离子反应;
B.该溶液为酸性溶液,溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
C.与Al反应能放出H2的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,与铝反应不会生成氢气;
D.水电离的c(H+)=1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,偏铝酸根离子、碳酸根离子都与氢离子反应.
解答 解:A.使酚酞变红色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Al3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.该溶液中氢氧根离子浓度为1×10-13mol•L-1,说明该溶液为酸性溶液,溶液中存在大量氢离子,NH4+、Ca2+、Cl-、NO3-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.与Al反应能放出H2的溶液中存在大量氢离子或氢氧根离子,Fe2+与氢氧根离子反应,NO3-在酸性条件下具有强氧化性,与铝反应不会生成氢气,在溶液中一定不能大量共存,故C错误;
D.水电离的c(H+)=1×10-13mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,AlO2-、CO32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查了离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能共存的情况,还需要把握题干暗含条件的含义,如:水电离的c(H+)=1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子、与Al反应能放出H2的溶液为酸性或强碱性溶液等,试题侧重考查学生的分析能力及逻辑推理能力.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
4.下表给出14-17号元素的一些性质,请回答:
(1)它们所形成的氢化物中稳定性最差的是SiH4,还原性最差的是HCl.
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
5.下列各说法正确的是( )
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=QKJ/mol(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ | |
| B. | 热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 小苏打在水中的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
9.对于反应A(g)+B(g)?3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与分解C的分子数相等
②外界条件不变时,A、B、C浓度不随时间变化
③体系温度不再变化
④恒容条件下体系的压强不再变化
⑤体系的分子总数不再变化.
①单位时间内A、B生成C的分子数与分解C的分子数相等
②外界条件不变时,A、B、C浓度不随时间变化
③体系温度不再变化
④恒容条件下体系的压强不再变化
⑤体系的分子总数不再变化.
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
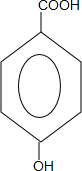
2. 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1mol苹果酸和足量的钠反应生成1.5moL的H2 | |
| D. | 1mol苹果酸与Na2CO3溶液反应必需消耗2mol Na2CO3 |
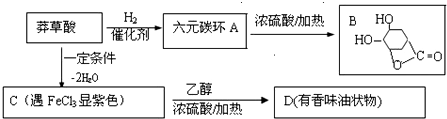
 .
. +CH3CH2OH$→_{△}^{浓硫酸}$H20+
+CH3CH2OH$→_{△}^{浓硫酸}$H20+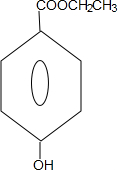 .
. 乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.
乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O. 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中: