题目内容
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如图,说法错误的是

A.流程②的反应说明Ⅰ的非金属性弱于Cl
B.经①和④所得溶液中,I-的浓度后者大于前者
C.氯元素的相对原子质量是35.5,则存在的35Cl、37Cl所占的百分比约为3:1
D.若在流程②和⑤中要得到等量的I2,则需消耗的n(Cl2):n(KClO3)=5:2
【答案】D
【解析】
A.流程②的反应方程式是Cl2+2I-=2Cl-+I2,氯气氧化性大于碘,所以说明 I 的非金属性弱于Cl,故A正确;
B.反应④的目的是富集碘元素,所以经①和④所得溶液中,I-的浓度后者大于前者,故B正确;
C.自然界中氯有35Cl、37Cl两种同位素原子,设原子个数比为x:y,氯元素的相对原子质量是35.5,则![]() ,x:y=3:1,故C正确;
,x:y=3:1,故C正确;
D.流程②中1molCl2转移2mol电子,流程⑤中1mol KClO3转移6mol电子,根据电子守恒,要得到等量的 I2,则需消耗的n(Cl2):n(KClO3)=3:1,故D错误。
答案选D。

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
CO的燃烧热为________。CO将NO2还原为单质的热化学方程式为______________。
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g) ![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:酸性HCO3-<HClO<H2CO3)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填填“小于”,“大于”)。
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
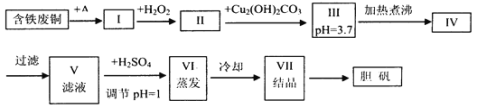
pH值控制可参考下列数据
物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用__(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的__。
(3)Ⅱ中加Cu2(OH)2CO3的目的是__,其优点是__。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为__。
(5)V中加H2SO4调节pH=1是为了__。