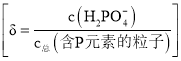题目内容
【题目】常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若定义pc是溶液中溶质的物质的量浓度的负对数,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示(已知:H2C2O4HC2O4-+H+ Ka1;HC2O4- C2O42-)+H+ Ka2)。则下列说法正确的是( )

A.pH=4时,c(HC2O4-)<c(C2O42-)
B.常温下,Ka1=10-0.7
C.pH=3~5.3的过程中水的电离程度增大
D.常温下,![]() 随pH的升高先增大后减小
随pH的升高先增大后减小
【答案】C
【解析】
若定义pc是溶液中溶质的物质的量浓度的负对数,浓度越大,pc越小,因此曲线I为pc(HC2O4-),曲线II为pc(H2C2O4),曲线III为pc(C2O42-)。
A. 根据分析,曲线I为pc(HC2O4-),曲线III为pc(C2O42-),当pH=4时,pc越小,浓度越大,根据图得出c(C2O42-) < c(HC2O4-),故A错误;
B. 常温下,再a点,c(H2C2O4)和c(HC2O4-)浓度相等,因此Ka1= c(H+) = 10-0.8,故B错误;
C. pH=3~5.3的过程不断加入碱,溶液酸性减弱,抑制水的电离程度减弱,水的电离程度增大,故C正确;
D. 常温下,![]() 随pH的升高而不变,故D错误。
随pH的升高而不变,故D错误。
综上所述,答案为C。

练习册系列答案
相关题目