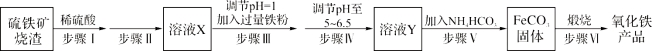题目内容
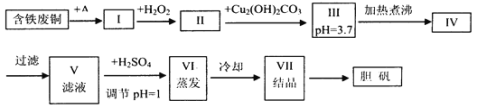
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用__(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的__。
(3)Ⅱ中加Cu2(OH)2CO3的目的是__,其优点是__。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为__。
(5)V中加H2SO4调节pH=1是为了__。
【答案】b 将![]() 氧化为
氧化为![]() 除去过量的硫酸 不引入新的杂质
除去过量的硫酸 不引入新的杂质 ![]() ↓
↓![]() 抑制
抑制![]() 的水解
的水解
【解析】
废铜(主要杂质为Fe)来制备胆矾的流程:将金属全部溶解,再将存在的亚铁离子氧化为铁离子,再结合![]() 开始沉淀时的pH值,可使Fe最终转化为
开始沉淀时的pH值,可使Fe最终转化为![]() 更容易除去,保证铜离子不会沉淀,不能引进杂质离子,加入
更容易除去,保证铜离子不会沉淀,不能引进杂质离子,加入![]() ,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁全转化为
,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁全转化为![]() .当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有
.当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有![]() ,阴离子有
,阴离子有![]() ,再加硫酸,调节溶液pH
,再加硫酸,调节溶液pH
=1,目的是抑制![]() 的水解,再分别进行蒸发浓缩、冷却结晶后,最终得到产品胆矾.
的水解,再分别进行蒸发浓缩、冷却结晶后,最终得到产品胆矾.
(1)A可选用浓硫酸、加热,稀硫酸不能溶解Cu,而浓FeCl3溶液、浓HNO3会引入杂质,因此,本题正确答案是:b;
(2) ![]() 与
与![]() 发生氧化还原反应,
发生氧化还原反应, ![]() 被氧化为
被氧化为![]() 后,调节pH,更容易除去,所以Ⅰ中加
后,调节pH,更容易除去,所以Ⅰ中加![]() 的目的将亚铁离子氧化为铁离子,因此,本题正确答案是:将
的目的将亚铁离子氧化为铁离子,因此,本题正确答案是:将![]() 氧化为
氧化为![]() ;
;
(3)在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁全转化为![]() ,并且不引入新的杂质,因此,本题正确答案是:除去过量的硫酸;不引入新的杂质;
,并且不引入新的杂质,因此,本题正确答案是:除去过量的硫酸;不引入新的杂质;
(4)Ⅲ加热煮沸时,促进铁离子水解,可以得到氢氧化铁沉淀,发生的化学反应的离子方程式为: ![]() ↓
↓![]() ,因此,本题正确答案是:
,因此,本题正确答案是: ![]() ↓
↓![]() ;
;
(5)V中加![]() 调节pH=1是为了抑制
调节pH=1是为了抑制![]() 的水解。
的水解。