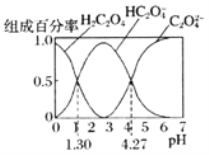
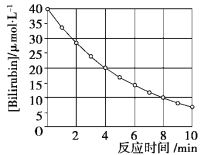
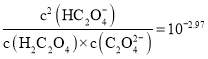题目内容
【题目】用0.1molL-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1molL-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法不正确的是( )

A.NaX溶液呈碱性B.P点:c(Na+)>c(H+)
C.M点:c(HX)+c(X-)=2c(Na+)D.M点水电离程度小于N点
【答案】B
【解析】
由图中起始点可知,P点所在的曲线应为强酸,即P点所在曲线为滴定HCl,M点所在的曲线为HX的滴定曲线,且HX为弱酸,
A.HX为弱酸,则NaX溶液由于X-的水解而呈碱性,A正确;
B.P点时为等浓度的NaCl与HCl的混合液,溶液中还存在水电离出的氢离子,故c(H+)>c(Na +),B错误;
C.M点存在等浓度的NaX与HX,存在c(HX)+c(X-)=2c(Na+),C正确;
D.M点HX未完全反应,有剩余,N点HX完全反应,生成NaX,可水解的盐促进水的电离,而酸抑制水的电离,故M点水电离程度小于N点,D正确;
故答案为B。

【题目】下列说法正确的是![]()
A.![]() 有机物
有机物![]() 的分子结构中含有的
的分子结构中含有的![]() 键数目一定为
键数目一定为![]()
B.一定温度下,氯化铵水解离子方程式:![]() ,若用
,若用![]() 表示的离子积,
表示的离子积,![]() 表示氨水电离常数,则氯化铵水解平衡常数
表示氨水电离常数,则氯化铵水解平衡常数![]()
C.已知反应:![]() :
:![]() :
:![]() ;则在酸性溶液中氧化性:
;则在酸性溶液中氧化性:![]()
D.已知
共价键 |
|
|
|
|
键能 | 360 | 436 | 431 | 176 |
则反应![]() 的焓变为:
的焓变为:![]()
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)反应③的ΔH____0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度相等,且均为0.1mol·L-1,则此时υ正____υ逆(填“>”、“=”或“<”)
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),测得有关数据如下:
CH3OCH3(g)+H2O(g),测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为____,
②该温度下的反应的平衡常数为____。
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变