题目内容
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
【答案】B
【解析】
A. A点对应溶液显酸性,即c(H+)>c(OH-),结合电荷关系判断;
B. pH=5.3时,![]() =0,即c(A-)=c(HA),结合HA酸的电离常数Ka的表达式进行计算;
=0,即c(A-)=c(HA),结合HA酸的电离常数Ka的表达式进行计算;
C. 在20mL HA溶液中加入10mL NaOH溶液,得到等浓度的HA和NaA混合溶液,根据题意判断出电离程度与水解程度的大小关系,再分析作答;
D. ![]() =
= ![]() =
=![]() =
=![]() ,Kh为A-的水解常数,据此分析判断。
,Kh为A-的水解常数,据此分析判断。
A. A点对应溶液显酸性,即c(H+)>c(OH-),溶液中电荷守恒关系为c(Na+)+c(H+)=c(A-)+c(OH-),所以离子浓度关系为c(A-)>c(Na+)>c(H+)>c(OH-),A项错误;
B. pH=5.3时,![]() =0,即c(A-)=c(HA),HA酸的电离常数Ka=
=0,即c(A-)=c(HA),HA酸的电离常数Ka=![]() =c(H+)=10-pH=10-5.3,B项正确;
=c(H+)=10-pH=10-5.3,B项正确;
C. 由于Ka=10-5.3>![]() =
= ![]() = Kh,所以20 mLHA溶液中加入10mL NaOH溶液,得到等浓度的HA和NaA混合溶液,混合溶液以电离为主,使c(A-)>c(HA),即
= Kh,所以20 mLHA溶液中加入10mL NaOH溶液,得到等浓度的HA和NaA混合溶液,混合溶液以电离为主,使c(A-)>c(HA),即![]() >0,故B点对应的NaOH溶液的体积小于10 mL,C项错误;
>0,故B点对应的NaOH溶液的体积小于10 mL,C项错误;
D. A-的水解常数Kh随温度升高而增大,所以![]() =
= ![]() =
=![]() =
=![]() ,随温度升高而减小,D项错误;
,随温度升高而减小,D项错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
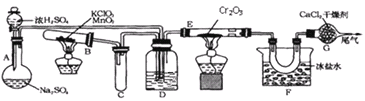
【题目】硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:
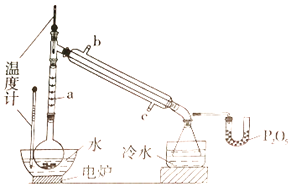
硼酸三甲酯 | 甲醇 | |
溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
沸点/℃ | 68 | 64 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
Na2B4O7·10H2O+2H2SO4+16CH3OH![]() 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为____________;直形冷凝管冷却水应从____________(填“b”或“c”)接口进入。
(2)本实验加热方式为____________,优点是____________。
(3)加入氯化钙盐析分层的主要目的是____________。
(4)U型管中P2O5的作用是_____________________________________。
(5)步骤④的仪器选择及安装都正确的是____________ (填标号),应收集____________℃的馏分。


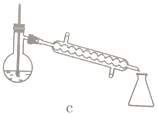
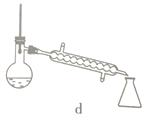
(6)本次实验的产率是____________。