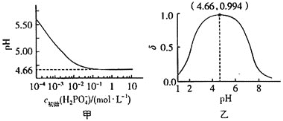
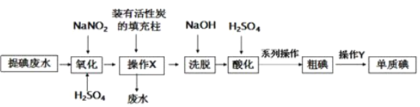
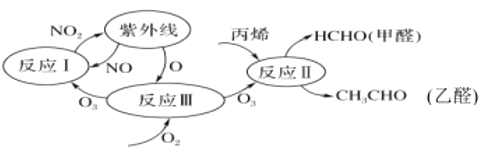
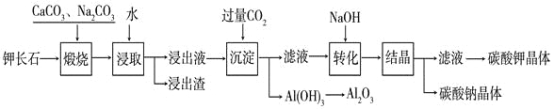
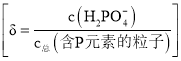��Ŀ����
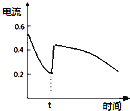
����Ŀ����KCl��CuSO4������Һ�������Ϻ���ʯī�缫���е�⣬�������У���ҺpH��ʱ��t�仯��������ͼ��ʾ��������˵����ȷ����
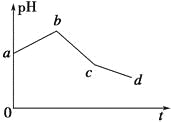
A.�������������缫��Ӧ2Cl����2e��=Cl2����2H����2e��=H2��������ͬʱ����
B.�����c��ʱ�������Һ�м�������CuCl2���壬����ʹ���Һ�ָ���ԭ����Ũ��
C.ab�α�ʾ��������H������ԭ��pH����
D.ԭ�����Һ��KCl��CuSO4��Ũ��֮��ǡ��Ϊ2��1
���𰸡�A
��������
KCl��CuSO4������Һ�������Ϻ���ʯī�缫���е�⣬����3���Σ�
[��һ��]����Ȼ�ͭ��������������ʧ���ӣ�������ͭ���ӵõ��ӣ���Ϊͭ����ˮ��ʹ��Һ�����ԣ����ŵ��Ľ��У�ͭ���ӵ�Ũ�Ƚ��ͣ����Լ�����pH������
[�ڶ���]�������ͭ������������������ʧ���ӣ���Դ��ˮ�ĵ��룩����������ȻΪͭ���ӵõ��ӣ���Ϊ�������������ģ�ʹˮ��Һ��������Ũ������pHѸ�ټ�С��
[������]��������ƣ�����������������ʧ���ӣ������������ӵõ��ӣ����Ƕ���Դ��ˮ�ĵ��룬ʵ���ǵ��ˮ��������Һ�������С��ʹ��Һ��������Ũ������pH������С
A���������Ϸ����������ӷ�Ӧ�꣬ͭ���ӻ�ʣ�������������������缫��Ӧ��2Cl--2e-�TCl2����2H++2e-�TH2��������ͬʱ���֣���A��ȷ��
B���������Ϸ����������c��ʱ���ڵ��Һ��Ӧ����CuCl2�����CuO���壬��B����
C���������Ϸ�������Ϊͭ����ˮ��ʹ��Һ�����ԣ����ŵ��Ľ��У�ͭ���ӵ�Ũ�Ƚ��ͣ����Լ�����pH������C����
D����Ϊ�ɵڶ�����������������ʧ���ӵ�ͬʱ��������ȻΪͭ���ӵõ��ӣ�����ԭ�����Һ��KCl��CuSO4��Ũ��֮�Ȳ���2��1����D����
��ѡA��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�