题目内容
下列有关电解质溶液的说法正确的是( )
| A、将pH=2的NH4Cl与pH=12氨水等体积混合,溶液中:c(NH4+)=c(Cl-) | ||||
| B、溶液中c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | ||||
| C、1.0mol?L-1的H2SO4溶液80℃时的pH大于25℃时pH | ||||
D、对氨水进行稀释,
|
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.将pH=2的NH4Cl与pH=12氨水等体积混合,溶液呈碱性,再结合电荷守恒判断;
B.如果溶液中的溶质为碳酸钠,则溶液存在c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
C.硫酸是强电解质,在水溶液中完全电离;
D.加水稀释氨水,促进一水合氨电离.
B.如果溶液中的溶质为碳酸钠,则溶液存在c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
C.硫酸是强电解质,在水溶液中完全电离;
D.加水稀释氨水,促进一水合氨电离.
解答:
解:A.将pH=2的NH4Cl与pH=12氨水等体积混合,一水合氨电离程度大于铵根离子水解程度,溶液呈碱性,再结合电荷守恒得c(NH4+)>c(Cl-),故A错误;
B.如果溶液中的溶质为碳酸钠,碳酸根离子水解导致溶液呈碱性,但水解程度较小,碳酸根离子和碳酸氢根离子水解都生成氢氧根离子,碳酸根离子水解生成碳酸氢根离子,溶液中氢离子浓度很小,所以溶液存在c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B正确;
C.硫酸是强电解质,在水溶液中完全电离,所以1.0mol?L-1的H2SO4溶液80℃时溶液中氢离子浓度相等,则溶液的pH相等,故C错误;
D.加水稀释氨水,促进一水合氨电离,溶液中铵根离子的物质的量增大、一水合氨物质的量减小,所以
将增大,故D错误;
故选B.
B.如果溶液中的溶质为碳酸钠,碳酸根离子水解导致溶液呈碱性,但水解程度较小,碳酸根离子和碳酸氢根离子水解都生成氢氧根离子,碳酸根离子水解生成碳酸氢根离子,溶液中氢离子浓度很小,所以溶液存在c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B正确;
C.硫酸是强电解质,在水溶液中完全电离,所以1.0mol?L-1的H2SO4溶液80℃时溶液中氢离子浓度相等,则溶液的pH相等,故C错误;
D.加水稀释氨水,促进一水合氨电离,溶液中铵根离子的物质的量增大、一水合氨物质的量减小,所以
c(N
| ||
| c(NH3?H2O) |
故选B.
点评:本题考查了弱电解质的电离,根据弱电解质电离特点及影响因素来分析解答,易错选项是C,注意:硫酸是强电解质,在水溶液中完全电离,不受温度影响,为易错点.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、1mol CH4(g)和2mol O2(g)的能量总和小于1mol CO2(g)和2mol H2O(g)的能量总和 |
| B、标准状况下,44.8L NO与22.4L O2混合后气体中分子总数小于2NA |
| C、1mol Fe在氧气中充分燃烧失去3NA个电子 |
| D、在标准状况下,NA个CHCl3分子所占的体积约为22.4L |
下列离子方程式与所述事实相符且正确的是( )
| A、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | ||||
| B、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | ||||
| C、向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | ||||
D、以铜为电极电解饱和食盐水:2Cl-+2H2O
|
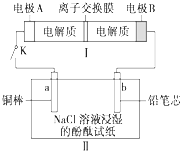 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr
| ||
| 放电 |
| A、负极反应为4Na-4e-═4Na+ |
| B、闭合K后,b电极附近的pH变小 |
| C、闭合K后,a电极上有气体产生 |
| D、当有0.01mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112mL |
下列表示正确的是( )
| A、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 |
| B、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ?mol-1 |
| C、将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
| D、在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
下列有关电极和电解质溶液构成的装置叙述不正确的是( )
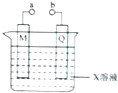

| A、若X、M、Q分别是H2SO4、Pb和PbO2,a、b连接后两极都有PbSO4生成 |
| B、若X、M、Q分别是CuSO4、Ag和Fe无论a、b是否连接Fe都被腐蚀 |
| C、若X、M、Q分别CuSO4、Cu和Fe,a、b是分别连接电源的正负极,则可对铁镀铜 |
| D、若X、M、Q分别是NaCl、C和Fe,则a、b连接后,M电极上有气体产生 |
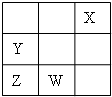 W、X、Y、Z为短周期元素,在周期表中位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、通常情况下四种元素的单质中,X化学性质最稳定 |
| B、四种元素都能与氢元素形成稳定的化合物 |
| C、Y、Z离子最外层电子数相同 |
| D、四种元素中Z元素最高价氧化物对应的水化物酸性最强 |
化学与科学、技术、社会、环境密切相关.下列叙述正确的是:①NO2、CO2和SO2都是大气污染物;②为了防止食品受潮变质,常在食品包装袋中放入活性铁粉;③单质硅是将太阳能转变为电能的常用材料;④维生素C易失电子,在人体内起抗氧化作用( )
| A、①② | B、②③ | C、③④ | D、①④ |
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
| A、Na2CO3和Na2O2 |
| B、Na2CO3和NaOH |
| C、NaOH和Na2O2 |
| D、NaOH、Na2O2和Na2CO3 |