题目内容
下列表示正确的是( )
| A、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 |
| B、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ?mol-1 |
| C、将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
| D、在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
考点:离子方程式的书写,离子共存问题
专题:离子反应专题
分析:A.Al3+、HCO3-相互促进水解,AlO2-促进HCO3-的电离;
B.CO(g)的燃烧热是283.0kJ?mol-1,则2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol;
C.发生氧化还原反应生成硫酸钙;
D.当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,可能发生I-、SO32-、NO3-的氧化还原反应.
B.CO(g)的燃烧热是283.0kJ?mol-1,则2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol;
C.发生氧化还原反应生成硫酸钙;
D.当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,可能发生I-、SO32-、NO3-的氧化还原反应.
解答:
解:A.Al3+、HCO3-相互促进水解,AlO2-促进HCO3-的电离,不能共存,故A错误;
B.CO(g)的燃烧热是283.0kJ?mol-1,则2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol,两个相反过程的反应热的数值相等,符号不同,所以2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ?mol-1,故B正确;
C.将SO2通入Ca(ClO)2溶液中发生Ca2++ClO-+SO2+H2O═CaSO4+2H++Cl-,故C错误;
D.当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,可能发生I-、SO32-、NO3-的氧化还原反应,气体为NO,则原溶液中可不含有CO32-,故D错误;
故选B.
B.CO(g)的燃烧热是283.0kJ?mol-1,则2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol,两个相反过程的反应热的数值相等,符号不同,所以2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ?mol-1,故B正确;
C.将SO2通入Ca(ClO)2溶液中发生Ca2++ClO-+SO2+H2O═CaSO4+2H++Cl-,故C错误;
D.当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,可能发生I-、SO32-、NO3-的氧化还原反应,气体为NO,则原溶液中可不含有CO32-,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重离子反应、离子共存及反应热的考查,综合性较强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列符号中“2”的含义依次正确的一组是( )
H 2He 2Cl Ca2+.
2 1 |
| A、质量数 中子数 质子数 电荷数 |
| B、质子数 中子数 原子个数 电荷数 |
| C、质量数 质子数 原子个数 电荷数 |
| D、质量数 质子数 中子数 电荷数 |
某化学学习小组学习电化学后,设计了下面的实验装置图:
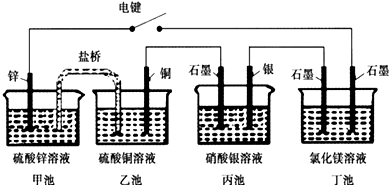
下列有关该装置图的说法中正确的是( )

下列有关该装置图的说法中正确的是( )
| A、合上电键后,盐桥中的阳离子向甲池移动 |
| B、合上电键后,丙池为电镀银的电镀池 |
| C、合上电键后一段时间,丙池中溶液的pH增大 |
| D、合上电键后一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生2.9g固体 |
下列有关电解质溶液的说法正确的是( )
| A、将pH=2的NH4Cl与pH=12氨水等体积混合,溶液中:c(NH4+)=c(Cl-) | ||||
| B、溶液中c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | ||||
| C、1.0mol?L-1的H2SO4溶液80℃时的pH大于25℃时pH | ||||
D、对氨水进行稀释,
|
某学生提供的实验数据如下,其中肯定错误的是( )
①用10mL的量筒量取5.60mL的液体
②用托盘天平称取22.5g KCl
③酸碱中和滴定时,消耗0.1000mol/L的盐酸23.25mL
④用广泛pH试纸测得某溶液的pH=4.4.
①用10mL的量筒量取5.60mL的液体
②用托盘天平称取22.5g KCl
③酸碱中和滴定时,消耗0.1000mol/L的盐酸23.25mL
④用广泛pH试纸测得某溶液的pH=4.4.
| A、①② | B、②③ | C、③④ | D、①④ |
1g氢气燃烧生成液态水放出142.9kJ的热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ?mol-1 | ||
B、H2(g)+
| ||
| C、2H2+O2═2H2O△H=571.6 kJ?mol-1 | ||
D、H2(g)+
|
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,A
B
C
D且D为强电解质(其它相关物质可能省略)下列说法不正确的是( )
| O2 |
| O2 |
| H2O |
| A、若A为非金属单质,则它与Mg反应的产物,其阴阳离子个数比可能为2:3 |
| B、若A为非金属单质,则其元素在周期表中的位置可能处于第二周期第IVA族 |
| C、不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化 |
| D、若A是共价化合物,O.1mol的A分子中含有的电子数可能为NA(NA为阿佛加德罗常数的值) |