题目内容
下列离子方程式与所述事实相符且正确的是( )
| A、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | ||||
| B、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | ||||
| C、向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | ||||
D、以铜为电极电解饱和食盐水:2Cl-+2H2O
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.氢氧化钠少量,碳酸氢钙中部分碳酸氢根离子发生反应生成碳酸钙沉淀;
B.磁性氧化铁为四氧化三铁,在离子方程式中四氧化三铁应该保留化学式;
C.亚铁离子还原性强于溴离子,亚铁离子优先与氯气反应,根据反应物的量判断反应产物;
D.铜为电解,阳极铜放电生成铜离子,阳极不会生成氯气;阴极水电离的氢离子得到电子生成氢气,同时生成氢氧根离子,铜离子与阴极生成的氢氧根离子反应生成氢氧化铜沉淀.
B.磁性氧化铁为四氧化三铁,在离子方程式中四氧化三铁应该保留化学式;
C.亚铁离子还原性强于溴离子,亚铁离子优先与氯气反应,根据反应物的量判断反应产物;
D.铜为电解,阳极铜放电生成铜离子,阳极不会生成氯气;阴极水电离的氢离子得到电子生成氢气,同时生成氢氧根离子,铜离子与阴极生成的氢氧根离子反应生成氢氧化铜沉淀.
解答:
解:A.碳酸氢钙溶液中加入少量NaOH溶液,碳酸氢根离子部分反应,正确的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故A错误;
B.磁性氧化铁溶于稀硝酸,磁性氧化铁为四氧化三铁,四氧化三铁应该保留化学式,正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故B错误;
C.含有0.4mol FeBr2的溶液中含有0.4mol亚铁离子和0.8mol溴离子,亚铁离子优先与氯气反应,0.4mol亚铁离子完全反应需要消耗0.2mol氯气,剩余的0.1mol氯气能够消耗0.2mol溴离子,反应的离子方程式为:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2,故C正确;
D.以铜为电极电解饱和食盐水,阳极为铜,阳极放电的不是氯离子,阳极铜放电生成铜离子,阳极生成氢气和氢氧根离子,铜离子与氢氧根离子反应生成氢氧化铜,正确的离子方程式为:Cu+2H2O═H2↑+Cu(OH)2↓,故D错误;
故选C.
B.磁性氧化铁溶于稀硝酸,磁性氧化铁为四氧化三铁,四氧化三铁应该保留化学式,正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故B错误;
C.含有0.4mol FeBr2的溶液中含有0.4mol亚铁离子和0.8mol溴离子,亚铁离子优先与氯气反应,0.4mol亚铁离子完全反应需要消耗0.2mol氯气,剩余的0.1mol氯气能够消耗0.2mol溴离子,反应的离子方程式为:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2,故C正确;
D.以铜为电极电解饱和食盐水,阳极为铜,阳极放电的不是氯离子,阳极铜放电生成铜离子,阳极生成氢气和氢氧根离子,铜离子与氢氧根离子反应生成氢氧化铜,正确的离子方程式为:Cu+2H2O═H2↑+Cu(OH)2↓,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;选项C为难点,注意亚铁离子优先反应,根据反应物离子的量判断产物;选项D为易错点,注意阳极放电的是金属铜.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各溶液中,物质的量浓度关系正确的是( )
| A、在0.1mol?L-1 CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| B、0.1mol?L-1的KAl(SO4)2溶液中:c(SO42-)>c(Al3+)>c(OH-)>c(H+) |
| C、pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有:c(NaOH)<c(CH3COONa)<c(NaHCO3) |
| D、等体积、等物质的量浓度的NaX和弱碱HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
第3周期元素的基态原子中,不可能出现d电子,主要依据是( )
| A、能量守恒原理 | B、泡利原理 |
| C、洪特规则 | D、构造原理 |
下列离子方程式中,不正确的是( )
| A、偏铝酸钠溶液中通入适量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| B、向FeCl3溶液中滴加几滴KSCN溶液:Fe3++SCN-═[Fe(SCN)]2+ |
| C、NaHCO3与足量石灰水反应:2HCO3-+Ca2++2OH-═2H2O+CaCO3↓+CO32- |
| D、偏铝酸钠溶液中加过量盐酸:AlO2-+4H+═Al3++2H2O |
某化学学习小组学习电化学后,设计了下面的实验装置图:
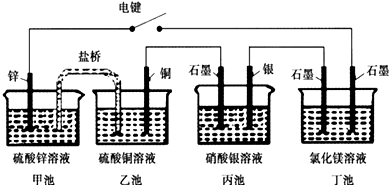
下列有关该装置图的说法中正确的是( )

下列有关该装置图的说法中正确的是( )
| A、合上电键后,盐桥中的阳离子向甲池移动 |
| B、合上电键后,丙池为电镀银的电镀池 |
| C、合上电键后一段时间,丙池中溶液的pH增大 |
| D、合上电键后一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生2.9g固体 |
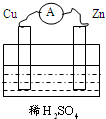 如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )
如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )| A、溶液中的H+向负极移动 |
| B、Zn片作负极,发生还原反应 |
| C、溶液的PH值将增大 |
| D、电子从Cu流出经导线流向Zn |
下列有关电解质溶液的说法正确的是( )
| A、将pH=2的NH4Cl与pH=12氨水等体积混合,溶液中:c(NH4+)=c(Cl-) | ||||
| B、溶液中c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | ||||
| C、1.0mol?L-1的H2SO4溶液80℃时的pH大于25℃时pH | ||||
D、对氨水进行稀释,
|
元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
| A、11和16 | B、6和8 |
| C、13和17 | D、20和9 |