��Ŀ����
11����1��CoCl2•6H2O���������ˮ������Ӽ����Ժ��ܷ��ϣ�������Fe��Al�����ʣ���ȡCoCl2•6H2O��һ�ֹ������£�
��֪��25��ʱ��Ksp[Fe��OH��3]=2.79��10-39
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 |
| ��ʼ������pH�� | 2.3 | 7.5 | 7.6 | 3.4 |
| ��ȫ������pH�� | 4.1 | 9.7 | 9.2 | 5.2 |
�ڼ���CoCO3��pHΪ5.2��7.6�������I��õ������ɷ�ΪFe��OH��3��Al��OH��3��
����֪��Fe��OH��3��s��?Fe3+ ��aq��+3OH-��aq����H=akJ/mol
 H2O��l���TH+ ��aq��+OH- ��aq����H=b kJ/mol
H2O��l���TH+ ��aq��+OH- ��aq����H=b kJ/mol��д��Fe3+����ˮ�ⷴӦ���Ȼ�ѧ����ʽ��Fe3+��aq��+3H2O��l��?Fe��OH��3��s��+3H+ ��aq����H=��3b-a��kJ/mol��ˮ��ƽ�ⳣ��Kh=$\frac{1{0}^{-3}}{2.79}$��
�ܼ��������pHΪ2��3��Ŀ��Ϊ����CoCl2ˮ�⣮
�ݲ��������Ϊ����Ũ������ȴ�ᾧ����������ƣ������ˣ�
��2��ij����ӵ��������LiCoO2����Li+�������Ϊ����ʣ����ʱ��Li+��ԭΪLi������ԭ����ʽǶ���ظ�������C6�У���ͼ��ʾ������ط�ӦΪLiCoO2+C6$?_{�ŵ�}^{���}$CoO2+LiC6��д���õ�طŵ�ʱ��������Ӧʽ��CoO2+Li++e-=LiCoO2��
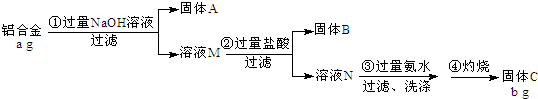
���� ��1�����ܷ����м������ϡ���ᣬFe��Al��ϡ���ᷴӦ����FeCl2��AlCl3��CoCl2������Һ�м���˫��ˮ��CoCO3��˫��ˮ����ǿ�����ԣ��ܽ�������������Ϊ�����ӣ����ӷ�Ӧ����ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O������CoCO3��������Һ��pH��7.6��ʹFe��OH��3��Al��OH��3���ɳ�����Ȼ����ˣ�����ΪFe��OH��3��Al��OH��3����Һ�к���CoCl2��Ȼ������Һ�м���ϡ���ᣬ����CoCl2ˮ�⣬Ȼ���������Ũ������ȴ�ᾧ���˷����õ�CoCl2•6H2O��
��˫��ˮ���������ԣ���������ԭ�����ӣ�
�ڼ���CoCO3��pHΪ5.2��7.6�������I��õ������ɷ�ΪFe��OH��3��Al��OH��3��
��Fe��OH��3��s��?Fe3+ ��aq��+3OH-��aq����H=akJ/mol
H2O��l���TH+ ��aq��+OH-��aq����H=b kJ/mol
Fe3+����ˮ�ⷴӦ����ʽΪFe3+��aq��+3H2O��l��?Fe��OH��3��s��+3H+ ��aq����H=��3b-a��kJ/mol��
25��ʱ��Ksp[Fe��OH��3]=2.79��10-39��ˮ��ƽ�ⳣ��Kh=$\frac{{c}^{3}��{H}^{+}��}{c��F{e}^{3+}��}$=$\frac{[\frac{{K}_{w}}{c��O{H}^{-}��}]^{3}}{c��F{e}^{3+}��}$=$\frac{��{K}_{w}��^{3}}{{K}_{sp}[Fe��OH��_{3}]}$��
��CoCl2Ϊǿ�������Σ�������ˮ�����Һ�����ԣ�����ϡ����������ˮ�⣻
�ݲ��������Ϊ����Ũ������ȴ�ᾧ�����ˣ�
��2���ŵ�ʱ����װ��Ϊԭ��أ������ϵõ��ӷ�����ԭ��Ӧ��
��� �⣺��1�����ܷ����м������ϡ���ᣬFe��Al��ϡ���ᷴӦ����FeCl2��AlCl3��CoCl2������Һ�м���˫��ˮ��CoCO3��˫��ˮ����ǿ�����ԣ��ܽ�������������Ϊ�����ӣ����ӷ�Ӧ����ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O������CoCO3��������Һ��pH��7.6��ʹFe��OH��3��Al��OH��3���ɳ�����Ȼ����ˣ�����ΪFe��OH��3��Al��OH��3����Һ�к���CoCl2��Ȼ������Һ�м���ϡ���ᣬ����CoCl2ˮ�⣬Ȼ���������Ũ������ȴ�ᾧ���˷����õ�CoCl2•6H2O��
��˫��ˮ����ǿ�����ԣ��ܽ�������������Ϊ�����ӣ����ӷ�Ӧ����ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ڼ���CoCO3��pHΪ5.2��7.6�������I��õ������ɷ�ΪFe��OH��3��Al��OH��3��
�ʴ�Ϊ��Fe��OH��3��Al��OH��3��
��Fe��OH��3��s��?Fe3+ ��aq��+3OH-��aq����H=akJ/mol
H2O��l���TH+ ��aq��+OH-��aq����H=b kJ/mol
Fe3+����ˮ�ⷴӦ����ʽΪFe3+��aq��+3H2O��l��?Fe��OH��3��s��+3H+ ��aq����H=��3b-a��kJ/mol��
25��ʱ��Ksp[Fe��OH��3]=2.79��10-39��ˮ��ƽ�ⳣ��Kh=$\frac{{c}^{3}��{H}^{+}��}{c��F{e}^{3+}��}$=$\frac{[\frac{{K}_{w}}{c��O{H}^{-}��}]^{3}}{c��F{e}^{3+}��}$=$\frac{��{K}_{w}��^{3}}{{K}_{sp}[Fe��OH��_{3}]}$=$\frac{��1{0}^{-14}��^{3}}{2.79��1{0}^{-39}}$=$\frac{1{0}^{-3}}{2.79}$��
�ʴ�Ϊ��Fe3+��aq��+3H2O��l��?Fe��OH��3��s��+3H+ ��aq����H=��3b-a��kJ/mol��$\frac{1{0}^{-3}}{2.79}$��
��CoCl2Ϊǿ�������Σ�������ˮ�����Һ�����ԣ�����ϡ����������ˮ�⣬���Լ���ϡ�����Ŀ��������CoCl2ˮ�⣬�ʴ�Ϊ������CoCl2ˮ�⣻
�ݲ��������Ϊ����Ũ������ȴ�ᾧ�����ˣ��ʴ�Ϊ����ȴ�ᾧ��
��2���ŵ�ʱ����װ��Ϊԭ��أ������ϵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪCoO2+Li++e-=LiCoO2��
�ʴ�Ϊ��CoO2+Li++e-=LiCoO2��
���� ���⿼�����ʷ�����ᴿ�����ԭ����Ϊ��Ƶ���㣬�漰������ԭ��Ӧ�����ʷ�����ᴿ�������Ȼ�ѧ����ʽ������ˮ�⡢�������ܽ�ƽ���֪ʶ�㣬���ؿ���ѧ��֪ʶ�����������ѵ���ˮ��ƽ�ⳣ�����㡢�缫��Ӧʽ����д����Ŀ�Ѷ��еȣ�

 ��У����ϵ�д�
��У����ϵ�д�| A�� | ÿ����2mol SO2��ͬʱ������2molSO3 | |
| B�� | �����������������ٱ仯 | |
| C�� | ÿ����2mol SO3��ͬʱ������1molSO2 | |
| D�� | ��������ѹǿ���ٱ仯 |
��
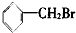 ��
��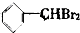 ��
�� ��
��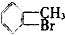 ��
�� ��
��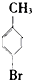 ��
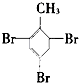
��
| A�� | ���٢ڢ� | B�� | ���� | C�� | ���ܢݢޢ� | D�� | ȫ�� |
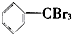
| A�� | �������Ӽ��ľ���һ�������Ӿ��� | |
| B�� | ���Ӿ�����һ���������ۼ� | |
| C�� | Na2O��SiO2�ľ����ж������ڵ������� | |
| D�� | �ɱ����ʾ����ۻ�ʱ�˷����������������������ͬ |
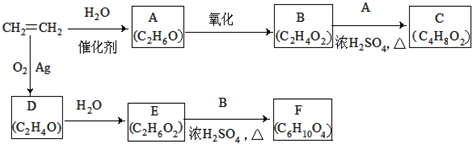
 ��
�� ��
��
 ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ���������ͼ��ʾװ�ý����й�ʵ�飮
ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ���������ͼ��ʾװ�ý����й�ʵ�飮