题目内容
4.某兴趣小组设计如图实验装置进行实验.
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置能(填“能”或“否”).
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液,C中反应的离子方程式为SO2+I2+2H2O═SO42-+2I-+4H+,D中反应的化学方程式为SO2+2H2S=3S↓+2H2O.
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体.查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S.常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2.该小组同学收集一定量黑色固体,按如下实验方案探究其成分:

(3)步骤Ⅱ中检验滤渣洗涤干净的实验方法是取最后一次洗涤液少许,滴加少量AgNO3溶液,若无明显现象,则洗涤干净.
(4)黑色固体的成分是CuO、CuS、Cu2S.
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.
(5)氨水吸收过量SO2的反应的离子方程为NH3•H2O+SO2=NH4++HSO3-.
分析 (1)A2制取装置不需要加热,能够节约能源和药品,用分液漏斗可以控制反应进行与停止;
(2)铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,检验二氧化硫漂白性可以通过品红试液;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;
(3)检验滤渣洗涤干净与否,实际是检验滤渣表面是否还有溶质粒子,本实验中滤渣表面可能会有氯离子;
(4)根据溶液颜色的变化及灼烧后固体质量的变化判断黑色固体的成分;
(5)过量二氧化硫和氨水反应生成亚硫酸氢铵.
解答 解:(1)装置图分析可知,A2的制取装置来代替A1装置,可以不需要加热或节约能源或药品,用分液漏斗加入硫酸可以控制反应速率,易于控制反应进行,符合绿色环保的目的,
故答案为:能;
(2)依据装置图可知,铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,C检验二氧化硫的还原性,D检验二氧化硫的氧化性,检验二氧化硫漂白性可以通过品红试液,品红褪色是二氧化硫气体的特性;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;反应的离子方程式为:SO2+I2+2H2O═SO42-+2I-+4H+;二氧化硫具有氧化性,能够与硫化氢反应生成硫单质和水,反应的化学方程式为:SO2+2H2S=3S↓+2H2O,
故答案为:品红溶液; SO2+I2+2H2O═SO42-+2I-+4H+;SO2+2H2S=3S↓+2H2O;
(3)检验滤渣洗涤干净与否,实际是检验滤渣表面是否还有溶质粒子,由于固体用盐酸溶解,所以中滤渣表面可能会有氯离子,可用硝酸银来检验,操作方法及现象为:取最后一次洗涤液少许,滴加少量AgNO3溶液,若无明显现象,则洗涤干净,
故答案为:取最后一次洗涤液少许,滴加少量AgNO3溶液,若无明显现象,则洗涤干净;
(4)根据用盐酸溶解后滤液变蓝,证明固体中含氧化铜,固体A为铜的硫化物,B为Cu2O.
若B全为Cu2S,2Cu2S+3O2$\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2
320 288
2g m1
解得m1=1.8
若B全为CuS,4CuS+5O2$\frac{\underline{\;高温\;}}{\;}$2Cu2O+4SO2
384 288
2g m2
解得:m2=1.5g
而实际得固体B为1.68g,介于m1和m2之间,所以固体A为Cu2S和CuS的混合物,
故答案为:CuO、Cu2S、CuS;
(5)氨水吸收过量SO2,反应生成亚硫酸氢铵,反应的离子方程式为:NH3•H2O+SO2=NH4++HSO3-,
故答案为:NH3•H2O+SO2=NH4++HSO3-.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,掌握常见物质的性质及检验方法为解答关键,注意明确性质实验方案设计的原则,试题培养了学生的分析能力、理解能力及灵活应用基础知识的能力.

 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是B<A<C | |
| B. | A元素最高价氧化物对应水化物具有强氧化性和不稳定性 | |
| C. | B元素的氧化物和氢化物的水溶液都呈酸性 | |
| D. | C元素的单质是非金属单质中唯一能跟水激烈反应的单质 |
| A. | 单质常用作半导体材料和光导纤 | B. | 在自然界中以化合态的形式存在 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |

(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大反应速率.
(2)步骤Ⅰ中所发生的主要反应的化学方程式为FeTiO3+C $\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑.
(3)将步骤Ⅱ中所发生的主要反应记为反应①,则①的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;800℃-900℃\;}}{\;}$TiCl4+2CO;有同学认为步骤Ⅱ中的物质转化中只需通入氯气,而无需加入焦炭就能实现,即发生反应②:TiO2+2Cl2 TiCl4+O2.已知相关数据如下:
| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解;反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2(填化学式),即可制得海绵钛.
(5)钛铁矿转化为粗TiO2也可以通过湿法完成:先用浓H2SO4溶解,将钛铁矿转化为TiO2+,然后使其水解得到粗TiO2.用酸清洗可除去粗TiO2中的Fe(OH)3杂质,已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下,Fe(OH)3(s)+3H+(aq)?Fe3+(aq)+3H2O(1)的平衡常数K=2.79×103.
(6)金属钛还可以通过电解直接获得.以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为TiO2+4e-=Ti+2O2-.
(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式CO2+NH3•H2O═NH4HCO3.
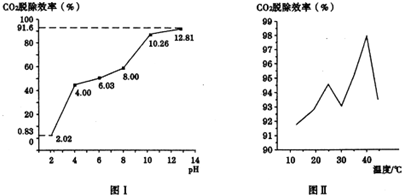
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图Ⅰ所示,CO2脱除效率与吸收剂的pH关系是CO2脱除效率随吸收剂的pH增大而增大.烟气中CO2的含量为12%,烟气通人氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量为0.13mol(精确到0.01).
③CO2脱除效率与温度的关系如图Ⅱ所示.从40℃到45℃脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成二氧化碳.
(2)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为
2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol.
①在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投人反应物,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.|x|+|y|<90.1 C.2p2<p3 D.a1+a3<1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若甲容器中反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数为44.4%(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).