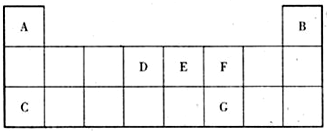
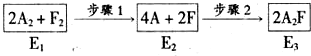题目内容
18.将12.8gMg、Al、Fe组成的合金溶于足量的NaOH溶液中,可产生0.3mol气体.另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,
其质量为38.3g,则上述反应中生成NO气体的体积(标准状况下)为( )
| A. | 11.2L | B. | 33.6L | C. | 22.4L | D. | 6.72L |
分析 由题意可知,氢氧化镁、氢氧化铝、氢氧化铁的总质量为38.3g,沉淀中氢氧根的质量为:38.3g-12.8g=25.5g,物质的量为:$\frac{25.5g}{17g/mol}$=1.5mol,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根的物质的量,再根据电子转移守恒计算NO的物质的量,据此计算体积.
解答 解:氢氧化镁、氢氧化铝、氢氧化铁的总质量为38.3g,根据金属的质量为12.8g可知沉淀中氢氧根的质量为:38.3g-12.8g=25.5g,物质的量为:$\frac{25.5g}{17g/mol}$=1.5mol,
根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,
设NO的物质的量为xmol,根据电子转移守恒可得:(5-2)×xmol=1.5mol,解得:x=0.5,
所以生成的标况下的NO的体积为:0.5mol×22.4L/mol=11.2L,
故选A.
点评 考查混合物的计算、反应方程式的计算等,题目难度中等,利用方程式计算步骤繁琐,本题采取守恒方法解答,判断金属提供的电子的物质的量等于氢氧根的物质的量是该方法的关键,注意化合物计算中守恒思想的运用.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用.下列化学反应中,不符合绿色化学概念的是( )
| A. | 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3 | |
| B. | 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O | |
| C. | 制硫酸铜:Cu+2H2SO4=CuSO4+SO2↑+2H2O | |
| D. | 制硫酸铜:2Cu+O2=2CuO CuO+H2SO4(稀)=CuSO4+H2O |
13.下列说法正确的是( )
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
10.下列有关电解质叙述正确的是( )
| A. | 熔融状态下能导电的物质是电解质 | |
| B. | BaSO4虽然难溶,但是强电解质 | |
| C. | NH3的水溶液能导电,所以NH3是电解质 | |
| D. | 弱电解质溶液的导电性比强电解质溶液弱 |
11.下列化学用语正确的是( )
| A. | 硫原子的原子结构示意图: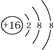 | |
| B. | 过氧化钠的电子式: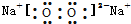 | |
| C. | 原子核内有8个质子、10个中子的氧原子:810O | |
| D. | HClO的结构式为 H-Cl-O |
12.一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A. | 单位时间内生成n molA2同时生成n molAB | |
| B. | 单位时间内生成2n molAB的同时生成n molB2 | |
| C. | 容器内气体总压强不再随时间的变化而变化 | |
| D. | 容器内混合气体的平均摩尔质量不再随时间的变化而变化 |