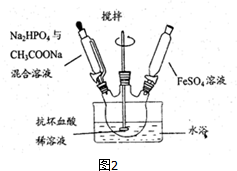
题目内容
8.下表是元素周期表中短周期部分,表中所列字母分别代表一种元素,回答有关问题.(均用元素符号或化学式表示)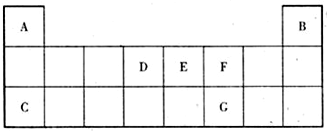
(1)A-G中非金属性最强的元素是O; 最不活泼的元素是He;A、C的最高价氧化物对应水化物中,碱性更强的是NaOH
(2)A和D可形成一种最10电子化合物,它的化学式为CH4这种化合物含共价键键.(填“离子键”或“共价键”)
(3)C和F离子半径较小的是Na+(填化学式)
(4)下图是A2与F2发生反应生成A2F的途径和三个状态的能量(E)则:
①步骤l是吸热(填“吸热”或“放热”)过程.
②比较E1、E2、E3的大小E2>E1>E3.(由大到小顺序排列)
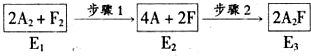
(5)元素E的氢化物能与它的最高价氧化物的水化物反应生成一种盐,化学方程式为NH3+HNO3=NH4NO3,该反应产物属于离子化合物(填“离子”或“共价”)
分析 由元素在周期表中的位置可知,A为H元素,B为He,C为Na;D为碳元素;E为N元素;F为O元素;G为D元素.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱;
稀有气体原子最外层为稳定结构,化学性质最不活泼;
金属性越强,最高价氧化物对应水化物的碱性越强;
(2)A和D可形成一种最10电子化合物为CH4,不同非金属元素原子之间形成的共价键;
(3)电子层结构相同的离子,核电荷数越大,离子半径越小;
(4)化学键断裂形成原子需要吸收能量,原子之间形成化学键放出能量;放热过程生成物的总能量小于反应物总能量,吸热过程生成物的总能量高于反应物总能量,结合氢气燃烧为放热反应判断;
(5)元素E的氢化物、最高价氧化物的水化物分别为NH3、HNO3,二者反应生成NH4NO3.
解答 解:由元素在周期表中的位置可知,A为H元素,B为He,C为Na;D为碳元素;E为N元素;F为O元素;G为D元素.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故A-G中非金属性最强的元素是O元素;
稀有气体He原子最外层为稳定结构,化学性质最不活泼;
H元素氧化物为水,呈中性,Na元素最高价氧化物对应水化物为NaOH,呈碱性,
故答案为:O;He;NaOH;
(2)A和D可形成一种最10电子化合物为CH4,含有共价键,故答案为:CH4;共价键;
(3)电子层结构相同的离子,核电荷数越大,离子半径越小,故离子半径:O2->Na+,故答案为:Na+;
(4)①步骤l中化学键断裂形成原子,应是吸热过程,故答案为:吸热;
②步骤1为吸热过程,故E2>E1,步骤2是原子之间形成化学键生成新物质,放出热量,故E2>E3,由于氢气燃烧为放热反应,故E1>E3,故E2>E1>E3,故答案为:E2>E1>E3;
(5)元素E的氢化物、最高价氧化物的水化物分别为NH3、HNO3,二者反应生成NH4NO3,化学方程式为:NH3+HNO3=NH4NO3,NH4NO3属于离子化合物,故答案为:NH3+HNO3=NH4NO3;离子.
点评 本题考查元素周期表、元素周期律、微粒半径比较、反应热等,题目较为综合,难度不大,注意基础知识的理解掌握.

| A. | 原子半径:Na>S>O | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 元素金属性:Na>Mg>Al |
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 某粒子${\;}_{z}^{A}$Rn+的核外电子数为Z+n | |
| C. | 41Ca与40Ca的失电子能力相同 | |
| D. | Cl?、S2?、Ca2+、K+半径逐渐减小 |
| A. | K电子层 | B. | L电子层 | C. | M电子层 | D. | N电子层 |
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜作负极 | |
| C. | 电子由外导线从锌流向铜,进入硫酸溶液后被H+得到而释放出H2 | |
| D. | 铜锌原电池工作时,若电路中通过0.4 mole-,锌片质量将减少13g |
| A. | F是最活泼非金属,Li是最活泼金属 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | NaOH易溶于水,Ca(OH)2微溶,所以NaOH碱性比Ca(OH)2强 |
 (1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:
(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下: