题目内容
12.一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )| A. | 单位时间内生成n molA2同时生成n molAB | |
| B. | 单位时间内生成2n molAB的同时生成n molB2 | |
| C. | 容器内气体总压强不再随时间的变化而变化 | |
| D. | 容器内混合气体的平均摩尔质量不再随时间的变化而变化 |
分析 通过化学方程式可知,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器的压强都不变,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答该题.
解答 解:A.消耗反应物的物质的量之比等于化学质量数之比,不能作为判断达到化学平衡的标志,故A错误;
B.位时间内生成2nmoLAB同时生成nmolB2,说明正逆反应速率相等,达到平衡状态,故B正确;
C.反应体系两边的计量数相等,容器内气体总压强始终不再随时间的变化而变化,故C错误;
D.反应体系两边的计量数相等,总物质的量不变,质量不变,所以容器内混合气体的平均摩尔质量始终不再随时间的变化而变化,故D错误;
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,本题易错点为CD,注意反应前后气体的化学计量数关系.

练习册系列答案
相关题目
18.将12.8gMg、Al、Fe组成的合金溶于足量的NaOH溶液中,可产生0.3mol气体.另取等质量合金溶于
过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,
其质量为38.3g,则上述反应中生成NO气体的体积(标准状况下)为( )
过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,
其质量为38.3g,则上述反应中生成NO气体的体积(标准状况下)为( )
| A. | 11.2L | B. | 33.6L | C. | 22.4L | D. | 6.72L |
20.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向硫酸铝溶液中滴加过量的氢氧化钡溶液 | 产生白色沉淀 | 氢氧化铝不溶于过量的氢氧化钡溶液 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.能正确表示下列反应的离子方程式是( )
| A. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | 氯化亚铁溶液中加入硝酸:Fe2++4H++NO3-=Fe3++2H2O+NO↑ | |
| C. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 氨水中通入过量CO2:2NH3•H2O+CO2=2NH4++CO32-+H2O |
1.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
2.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | 28gN2和CO的混合气体中含有的分子数为NA |
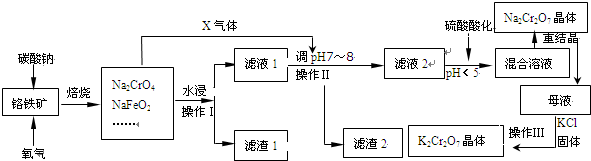
 .
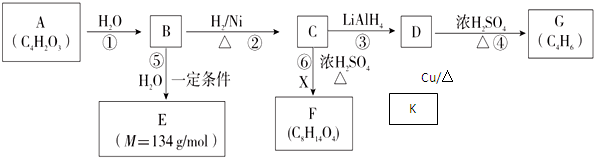
.
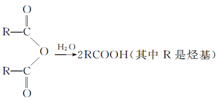 ②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基)
②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基) ;B中含氧官能团的名称是羧基;
;B中含氧官能团的名称是羧基;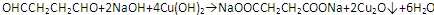
 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.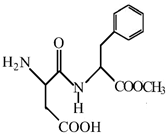 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.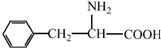 是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
 .
.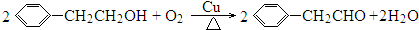
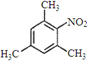 .
.