题目内容
3.常温下,用0.100mol/L的NaOH溶液作标准液滴定0.100mol/L的HCl.(已知:HCl的体积为20ml,lg2=0.3)求:(1)滴定前HCl溶液的pH值是多少?(2)当滴定NaOH溶液至19.98ml时,溶液的pH值是多少?
(3)当滴加NaOH溶液至20.02ml时,溶液的pH值是多少?
分析 (1)HCl为强电解质,在水中完全电离,先计算0.100mol/L的HCl氢离子浓度,然后根据PH=-lgc(H+)计算;
(2)当滴定NaOH溶液至19.98ml时,根据n=cV分别计算出氯化氢、氢氧化钠的物质的量,然后比较得出碱的量不足,溶液呈酸性,计算出混合液中氢离子浓度,最后计算出混合液的pH;
(3)当滴加NaOH溶液至20.02ml时,根据n=cV分别计算出氯化氢、氢氧化钠的物质的量,然后比较得出碱的量过量,溶液呈碱性,先计算出混合液中氢氧离子浓度,然后根据KW=c(H+)×c(OH-)计算出混合液的氢离子浓度,最后根据PH=-lgc(H+)计算出混合液的pH.
解答 解:(1)HCl为强电解质,在水中完全电离,0.1mol•L-1盐酸溶液中氢离子浓度为:c(H+)=0.1mol/L,
溶液的pH,PH=-lgc(H+)=-lg0.100=1,
答:滴定前HCl溶液的pH值是1;
(2)HCl的体积为20ml,当滴加NaOH溶液至19.98 ml时,即NaOH不够量,少滴0.02 ml,溶液呈酸性,
c(H+)=$\frac{0.100mol/L×(20.00-19.98)×1{0}^{-3}L}{(20+19.98)×1{0}^{-3}L}$=$\frac{2×1{0}^{-3}}{39.98}$mol/L=5×10-5mol/L,PH=-lgc(H+)=-lg5×10-5=5-lg5=4.3,
答:当滴定NaOH溶液至19.98ml时,溶液的pH值是4.3,
(3)HCl的体积为20ml,当滴加NaOH溶液至20.02 ml时,即NaOH溶液多滴0.02 ml,碱过量,溶液呈碱性,c(OH-)=$\frac{0.100mol/L×(20.02-20)×1{0}^{-3}L}{(20+20.02)×1{0}^{-3}L}$=5×10-5mol/L,KW=c(H+)×c(OH-),c(H+)=
$\frac{1×1{0}^{-14}}{5×1{0}^{-5}}$mol/L=2×10-10 mol/L,PH=-lgc(H+)=-lg2×10-10=9.7,
答:当滴加NaOH溶液至20.02ml时,溶液的pH值9.7.
点评 本题考查了酸碱混合的pH计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的表达式及计算方法,试题侧重考查学生的分析能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜作负极 | |
| C. | 电子由外导线从锌流向铜,进入硫酸溶液后被H+得到而释放出H2 | |
| D. | 铜锌原电池工作时,若电路中通过0.4 mole-,锌片质量将减少13g |
| A. | 常温下,某溶液中由水电离出的c(H+)=10-5 mol•L-1,则此溶液可能是盐酸 | |
| B. | pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为:①>②>③ | |
| C. | 0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合: c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
| A. | HCl | B. | BaCO3 | C. | NaCl | D. | SO3 |
过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,
其质量为38.3g,则上述反应中生成NO气体的体积(标准状况下)为( )
| A. | 11.2L | B. | 33.6L | C. | 22.4L | D. | 6.72L |
| A. | 电解时阳极获得O2 | |
| B. | 电解时阴极获得海绵钛 | |
| C. | 电解时阳极有Cl2放出 | |
| D. | 电解工艺一旦投入实际生产,钛将可与不锈钢和铝合金竞争 |
| A. | 分子式表明了分子中各原子的个数和连接方式 | |
| B. | 结构式、结构简式可表示分子中各原子的连接方式和相对位置 | |
| C. | 球棍模型可表示分子的真实形态 | |
| D. | 比例模型较真实反映分子空间构型 |
 .
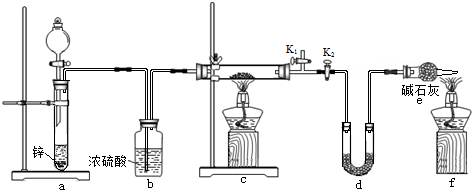
.
 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.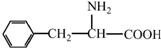 是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
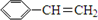 .
.
 .
.