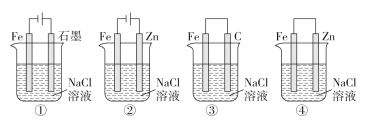
题目内容
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:
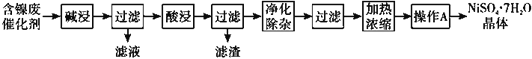
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为2A1+2OH-+2H2O=2AlO2—+3H2↑,_________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,此时的pH为____________(保留1位小数)。
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在NaOH溶液中可被NaClO氧化为NiOOH,该反应的化学方程式为_______。
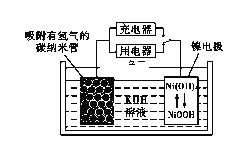
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其充电时,正极的电极反应式为____________。
【答案】Al2O3+2OH-=2AlO2-+H2O 稀硫酸(或硫酸、H2SO4) 将Fe2+氧化为Fe3+ 2.7 冷却结晶 2NiSO4+NaClO+4NaOH=2NiOOH↓+NaCl+H2O+2Na2SO4 Ni(OH)2+OH--e-=-NiOOH+H2O
【解析】
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质,工艺流程的目的是用含镍废催化剂制备NiSO4·7H2O晶体,分析工艺流程,将含Ni废催化剂碱浸,Al和Al2O3溶于碱生成AlO2-,进行过滤操作,则Fe、Ni及其他不溶于碱的杂质被过滤出,进行酸浸,则Fe和Ni溶于酸形成Fe2+和Ni2+,进行过滤操作,则不溶于酸的杂质被过滤出,滤液中主要含有Fe2+和Ni2+,净化除杂主要除去Fe元素得到Ni元素的溶液,经过后续处理得到NiSO4·7H2O晶体。
(1)“碱浸”时Al和Al2O3溶于碱生成AlO2-,“碱浸”时发生反应的离子方程式为2A1+2OH-+2H2O=2AlO2—+3H2↑,Al2O3+2OH-═2AlO2-+H2O。
(2)工艺流程最终目的是制备NiSO4·7H2O晶体,所以酸浸时所用的酸应为H2SO4。
(3)“净化除杂”需加入H2O2溶液,其作用是氧化Fe2+为Fe3+,Fe3+更易形成Fe(OH)3从而达到去除Fe元素的目的;然后调节pH使溶液中铁元素恰好完全沉淀,溶液中c(Fe3+)浓度低于10-5mol·L-1可认为Fe3+几乎完全被除去,此时溶液中c(OH-)=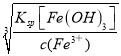 =10-11.3mol·L-1,则pH=14-pOH=14+lgc(OH-)=2.7;
=10-11.3mol·L-1,则pH=14-pOH=14+lgc(OH-)=2.7;
(4)溶液中存在NiSO4,经过加热浓缩及“操作A”为冷却结晶、过滤、洗涤、干燥,即得产品。
(5)NiSO4在NaOH溶液中可被NaClO氧化为NiOOH,ClO-被还原为Cl-,该反应的化学方程式为2NiSO4+NaClO+4NaOH=2NiOOH↓+NaCl+H2O+2Na2SO4。
(6)NiOOH可作为镍氢电池的电极材料,充电时阳极发生氧化反应,所以电极反应为:Ni(OH)2+OH--e-=NiOOH+H2O。