题目内容
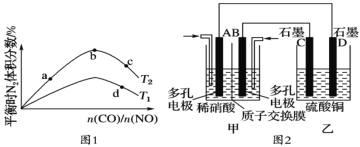
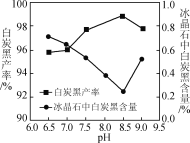
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
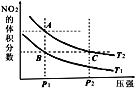
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B>C
【答案】B
【解析】
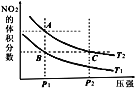
反应是吸热反应,从B到A,二氧化氮的体积分数增大,正向移动,即加热,T1 < T2。
A选项,A、C两点温度相同,压强C点大于A点,因此反应速率:C > A,故A错误;
B选项,A到C加压,体积缩小,气体的颜色:A浅,C深,故B正确;
C选项,根据![]() ,B到A,正向移动,A点物质的量比B点大,其平均相对分子质量:B > A,故C错误;
,B到A,正向移动,A点物质的量比B点大,其平均相对分子质量:B > A,故C错误;
D选项,B、C两点,C点温度高,平衡正向移动,化学平衡常数:C > B,故D错误;
综上所述,答案为B。

【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:
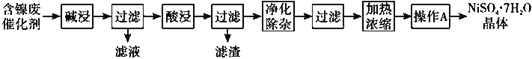
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为2A1+2OH-+2H2O=2AlO2—+3H2↑,_________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,此时的pH为____________(保留1位小数)。
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在NaOH溶液中可被NaClO氧化为NiOOH,该反应的化学方程式为_______。
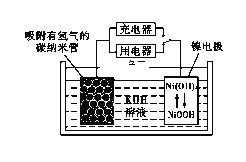
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其充电时,正极的电极反应式为____________。