题目内容
【题目】下列与金属腐蚀有关的说法,正确的是


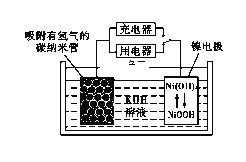
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
【答案】D
【解析】
A.铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快,插入海水中的铁棒,越靠近底端氧气的浓度越小,则腐蚀越轻,故A错误;
B.该装置为电解池,铁棒连接了电源的负极,为电解池的阴极,所以铁棒被保护,不易腐蚀,故B错误;
C.温度越高,铁越容易被氧化,所以高温下铁越容易生锈,主要是高温下Fe发生化学腐蚀,故C错误;
D.用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁作负极而易被腐蚀,铁作正极被保护,故D正确;
故选D。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
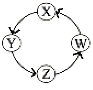
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(ClO)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。

(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:
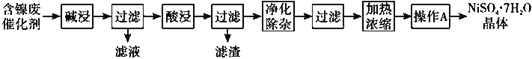
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为2A1+2OH-+2H2O=2AlO2—+3H2↑,_________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,此时的pH为____________(保留1位小数)。
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在NaOH溶液中可被NaClO氧化为NiOOH,该反应的化学方程式为_______。
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其充电时,正极的电极反应式为____________。