题目内容
【题目】下列关于电化学的叙述正确的是( )
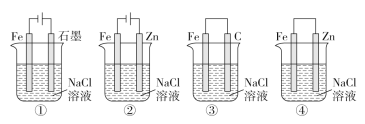
A. 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B. 图②装置中Fe电极参与反应发生腐蚀
C. 图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D. 上述4个装置中,图①、②中Fe腐蚀速率较快,图③中Fe腐蚀速率较慢
【答案】C
【解析】
A. 图①是用惰性电极电解食盐水,石墨是阳极生成氯气、铁是阴极生成氢气,滴加酚酞溶液时铁极变红,故A错误;
B. 图②装置中Fe是阴极,铁电极不参与反应,锌是阳极,锌被腐蚀,故B错误;
C. 图③溶液呈中性,可以模拟钢铁的吸氧腐蚀,碳棒是正极,电极反应式:O2+2H2O+4e-=4OH-,故C正确;
D. 上述4个装置中,图①、②中Fe都是电解池的阴极,腐蚀速率慢,图③中Fe是原电池负极,腐蚀速率较快,故D错误;
答案选C。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目