题目内容
17.T℃下,某2L容器内A、M、N三种物质参与的某一化学反应:2A(g)?M(g)+2N(g)
①其物质的量随反应时间的变化的曲线如图1,此反应0~5min反应物A的反应速率为0.2mol/(L•min)则该反应在T℃的化学平衡常数为0.5.
②若为了寻找该反应的最佳条件,在反应过程中持续不断地升高温度,所得的M的体积分数如图2,则该反应的△H<0(填“>”或“<”).
(2)氮的氢化物肼(N2H4)是航天火箭发射常用的燃料.
①发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水.该反应的化学方程式为2N2H4+2NO2$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O.
②工业上可采用电化学的方法获得N2H4,装置如图3所示,则通入氨气的一极为负极.该电极反应式为2NH3-2e-+2OH-=N2H4+2H2O.
③将标准状况下112mL CO2通入100mL 0.1mo1/L的氨水中,所得溶液碱显碱性,则溶液中离子浓度由大到小的顺序为c(NH4+)>c(CO32-)>C(OH-)>c(HCO3-)>c(H+);该溶液中,c(HCO3-)+c(CO32-)+c(H2CO3)=0.05mol/L(忽略溶液体积的变化)
分析 (1)①根据v=$\frac{△c}{△t}$计算出0~5min反应物A的反应速率;平衡常数与温度有关,根据5min时的数据可以计算出该反应的平衡常数;
②根据图2可知,该可逆反应达到平衡状态后,升高温度M的含量减少,则说明平衡向着逆向移动,据此判断该反应的焓变;
(2)①反应物为肼和二氧化氮,反应产物为氮气和水,根据化合价变化相等配平该反应;
②负极发生氧化反应、正极发生还原反应,根据化合价变化判断通入氨气电极;氨气在碱性条件下失去电子生成肼,据此写出该电极反应式;
③计算出二氧化碳、一水合氨的物质的量,判断溶质组成,然后结合盐的水解原理判断各离子浓度大小;根据物料守恒可知:c(HCO3-)+c(CO32-)+c(H2CO3)=$\frac{0.005mol}{0.1L}$=0.05mol/L.
解答 解:(1)①根据图1可知,5min时A的物质的量变化为:4mol-2mol=2mol,则0~5min反应物A的反应速率为:v(A)=$\frac{\frac{2mol}{2L}}{5min}$=0.2mol/(L•min); 平衡时M的浓度为:$\frac{1mol}{2L}$=0.5mol/L,A的浓度为:$\frac{2mol}{2L}$=1mol/L,根据反应2A(g)?M(g)+2N(g)可知,平衡时N的浓度为1mol/L,则该反应的平衡常数为:K=$\frac{0.5×1}{1}$=0.5,
故答案为:0.2mol/(L•min); 0.5;
②从图2可知,升高温度后M的含量减少,说明化学平衡向着逆向移动,则逆向是吸热反应,所以正反应为放热反应,故△H<0,
故答案为:<;
(2)①发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水,肼中N元素的化合价为-2价,反应后变为0价,化合价升高2价,至少升高4价;二氧化氮中氮元素的化合价为+4价,反应后变为0价,化合价降低4价,则肼和二氧化氮的计量数相等,再结合质量守恒定律配平后的化学方程式为:2N2H4+2NO2$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O,
故答案为:2N2H4+2NO2$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O;
②氨气转化成N2H4,化合价从-3变为-2,化合价升高被氧化,则通入氨气的一极为负极;负极氨气失去电子,在碱性条件下生成N2H4,负极的是电极反应式为:2NH3-2e-+2OH-=N2H4+2H2O,
故答案为:负极;2NH3-2e-+2OH-=N2H4+2H2O;
③标准状况下112mL CO2的物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,100mL 0.1mo1/L的氨水中含有一水合氨的物质的量为0.01mol,二者恰好反应生成碳酸铵,溶液显示碱性,则c(OH-)>c(H+),说明碳酸根离子的水解程度大于铵根离子,由于氢氧根来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-);由于水解程度减小,则c(NH4+)>c(CO32-),溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
根据溶液中的物料守恒可知:c(HCO3-)+c(CO32-)+c(H2CO3)=$\frac{0.005mol}{0.1L}$=0.05mol/L,
故答案为:c(NH4+)>c(CO32-)>C(OH-)>c(HCO3-)>c(H+);0.05mol/L.
点评 本题考查了物质的量随时间变化的曲线,题目难度中等,涉及化学平衡及其计算、电解原理、原电池及应用、化学方程式的书写、离子浓度大小比较等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力.

| A. | 除去溶液中Ag+加盐酸盐比硫酸盐好 | |
| B. | 加入H20,溶解平衡不移动 | |
| C. | 用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 | |
| D. | 反应2AgCl+Na2S═Ag2S+2NaCl 说明溶解度:AgCl>Ag2S |
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其1支加入少量MnO2,可以研究催化剂对H2O2分解速率的影响 | |
| C. | 热稳定性:HF>HC1>HBr>HI | |
| D. | 中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量相等 |
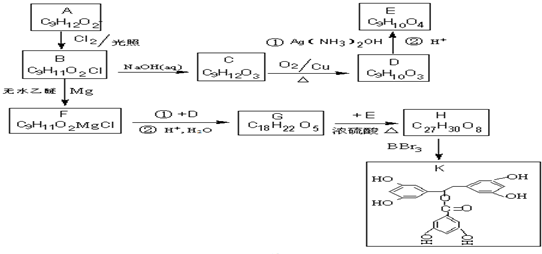
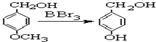
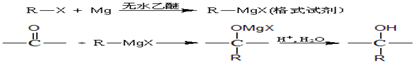
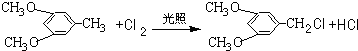 .
.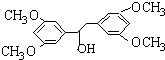 ;
;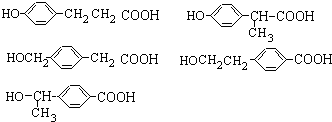 (任意3个);.
(任意3个);.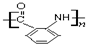 .(无机试剂任选.用流程图表示:写出反应物、产物及主要反应条件).
.(无机试剂任选.用流程图表示:写出反应物、产物及主要反应条件).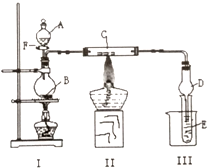 用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.
用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.
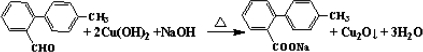 .
. 与
与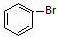 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: .
.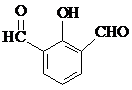 、
、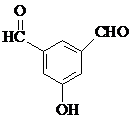 、
、
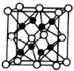 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
 ;Z的电子式是
;Z的电子式是 .
.