题目内容
5.下列叙述正确的是( )| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其1支加入少量MnO2,可以研究催化剂对H2O2分解速率的影响 | |
| C. | 热稳定性:HF>HC1>HBr>HI | |
| D. | 中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量相等 |
分析 A.室温下,pH=7的溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断c(Na+)、c(CH3COO-)相对大小;
B.该实验中有两个变量;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.醋酸是弱电解质,部分电离;氯化氢是强电解质,完全电离,所以pH相等的醋酸和盐酸,醋酸浓度大于盐酸,等体积等pH的醋酸物质的量大于盐酸,酸的物质的量越多消耗NaOH的物质的量越多.
解答 解:A.室温下,pH=7的溶液呈中性,则c(H+)=c(OH-),根据电荷守恒应为c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故A错误;
B.该实验中有两个变量,所以不能研究催化剂对反应速率的影响,应加入相同体积相同浓度的H2O2溶液,故B错误;
C.元素的非金属性越强,氢化物越稳定,非金属性F>Cl>Br>I,所以氢化物的稳定性HF>HC1>HBr>HI,故C正确;
D.醋酸是弱电解质,部分电离;氯化氢是强电解质,完全电离,所以pH相等的醋酸和盐酸,醋酸浓度大于盐酸,等体积等pH的醋酸物质的量大于盐酸,酸的物质的量越多消耗NaOH的物质的量越多,所以中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量应为醋酸多,故D错误;
故选C.
点评 本题考查较综合,涉及弱电解质的电离、非金属性强弱判断、化学反应速率影响因素、离子浓度大小比较等知识点,明确弱电解质电离特点、溶液中存在电荷守恒、非金属性强弱判断方法即可解答,易错选项是B.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列有关实验的解释或说明正确的是( )
| A. | 为了加快过滤速度,可用减压过滤或边过滤边用玻璃棒搅拌 | |
| B. | 当沉淀的密度较大时,从液体分离出沉淀可用倾析法,它的优点是操作简单,速度快 | |
| C. | 为了减弱铜锌原电池中的极化现象,可在溶液中加入少量的双氧水 | |
| D. | 硝酸银是鉴别食盐和工业盐的最简单的试剂之一 |
16.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H20与NH4CI的反应 | ||
| C. | 甲烷在02中的燃烧反应 | D. | 灼热的炭与C02反应 |
20.下列热化学方程式或离子方程式正确的是( )
| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为: H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
10.下列说法正确的是( )
| A. | 按系统命名法,CH3CH(C2H5)CH2CH(CH3)2的命名为:2-甲基-4-乙基戊烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. |  的单体是CH3-C=C-CH3和CH2=CH-CN 的单体是CH3-C=C-CH3和CH2=CH-CN | |
| D. | 已知 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 |
8.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | FeCl3 | B. | NH3 | C. | NH4HCO3 | D. | Cl2 |
9.氨的合成是最重要的化工生产之一.
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+3H2(g)△H4,已知有关反应的能量变化如图1所示:
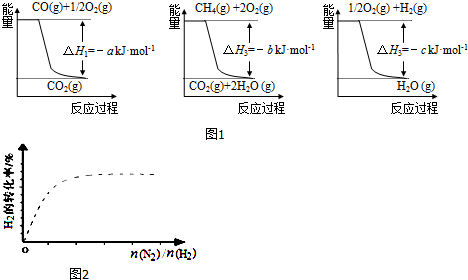
则△H4=(a+3c-b)kJ•mol-1(用a、b、c表示)
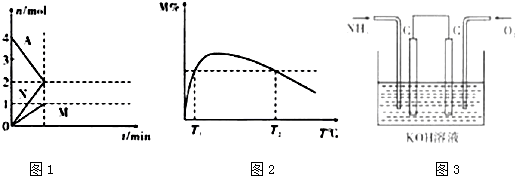
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温高压}$2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
①甲容器达到平衡所需要的时间t=5min(填“>”、“<”或“=”,下同);乙容器达到平衡时N2的浓度c=3mol•L-1.
②图2中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图.
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+3H2(g)△H4,已知有关反应的能量变化如图1所示:

则△H4=(a+3c-b)kJ•mol-1(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温高压}$2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
②图2中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图.
 .
.