题目内容
7.下表是无素周期表的一部分,表中所列的字线分别代表一种化学元素.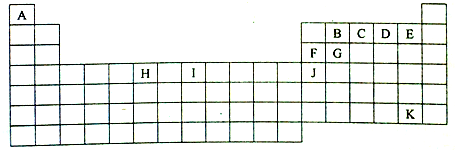
请回答下列问题:
(1)K的元素符号At,I元素的周期表的位置第四周期第Ⅷ族.
(2)写出基态时H元素原子的电子排布式1S22S22P63S23P63d54s1.
(3)已知BA4的燃烧热为890.31kJ/mol,写出表示其燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31kJ/mol.
(4)A、B、D可以形成多种多样的化合物,X、Y为其中两种有机化合物.X分子中含B、A、D的原子个数分别为1、4和1;Y中含B、A、D的原子个数分别为1、2和1,则X的电子式为
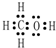 ,Y的中心原子杂化方式为SP2.
,Y的中心原子杂化方式为SP2.(5)下列对比正确的是ab.
a.电负性B>G>F>J b.最高价氧化物的水化物酸性C>B>G>F
c.原子半径G>F>C>B d.第一电离能E>D>C.
分析 由元素在周期表中位置,可知A为氢、B为碳、C为N、D为O、E为、F为Al、G为Si、H为Cr、I为Fe、J为Ga、K为At.
(1)K为At元素;I位于周期表中第四周期第Ⅷ族;
(2)H为Cr,核外电子数为24,根据能量最低原理书写核外电子排布式;
(3)1mol甲烷完全燃烧生成二氧化碳与液态水放出的热量为其燃烧热,注明物质的聚集状态与反应热,书写其燃烧热的热化学方程式;
(4)H、C、O可以形成多种多样的化合物,X、Y为其中两种有机化合物.X分子中含C、H、O的原子个数分别为1、4和1,则X为CH3OH,Y中含C、H、O的原子个数分别为1、2和1,则Y为HCHO;
(5)a.同周期自左而右电负性增大、同主族自上而下电负性减小;
b.非金属性越强,最高价含氧酸的酸性越强;
c.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
d.同周期随原子序数增大,第一电离能呈增大趋势,但ⅡA、ⅤA族元素第一电离能共有同周期相邻元素.
解答 解:由元素在周期表中位置,可知A为氢、B为碳、C为N、D为O、E为、F为Al、G为Si、H为Cr、I为Fe、J为Ga、K为At.
(1)K为At元素;I位于周期表中第四周期第Ⅷ族,故答案为:At;第四周期第Ⅷ族;
(2)H为Cr,核外电子数为24,核外电子排布式为1S22S22P63S23P63d54s1,
故答案为:1S22S22P63S23P63d54s1;
(3)CH4的燃烧热为890.31kJ/mol,其燃烧热的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31kJ/mol;
(4)H、C、O可以形成多种多样的化合物,X、Y为其中两种有机化合物.X分子中含C、H、O的原子个数分别为1、4和1,则X为CH3OH,电子式为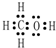 ,Y中含C、H、O的原子个数分别为1、2和1,则Y为HCHO,分子中C原子形成3个σ键、没有孤电子对,C原子采取SP2杂化,
,Y中含C、H、O的原子个数分别为1、2和1,则Y为HCHO,分子中C原子形成3个σ键、没有孤电子对,C原子采取SP2杂化,
故答案为: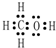 ;SP2;
;SP2;
(5)a.同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性B>G>F>J,故正确;
b.非金属性C>B>G>F,非金属性越强,最高价含氧酸的酸性越强,故中国结含氧酸的酸性:C>B>G>F,故正确;
c.同周期自左而右原子半径减小、同主族自上而下原子半径增大.故原子半径:F>G>B>C,故错误;
d.同周期随原子序数增大,第一电离能呈增大趋势,但ⅡA、ⅤA族元素第一电离能共有同周期相邻元素,故第一电离能E>C>D,故错误,
故选:ab.
点评 本题考查元素周期表、热化学方程式、核外电子排布、电子式、杂化方式、元素周期律等,难度不大,侧重对基础知识的考查,注意同周期的第一电离能异常情况.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 铵盐都易溶于水 | |
| B. | 由于易溶,Na+、K+、NH4+都不可能在相关离子方程式中出现 | |
| C. | NH4Cl的分解与NH3、HCl的化合不属于可逆反应 | |
| D. | 铵盐都能与NaOH反应 |
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=b J•mol-1
2H2(g)+O2(g)=2H2O(g);△H=c kJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=d kJ•mol-1
下列关系式中正确的是( )
| A. | b<a<0 | B. | b>d>0 | C. | 2a=d>0 | D. | 2b=c<0 |
| A. | c(H+) | B. | 醋酸电离的程度 | ||
| C. | 中和时所需 NaOH的量 | D. | 醋酸的物质的量 |
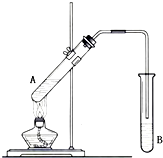 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.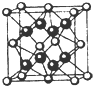 已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
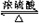 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. +CaCl2+H2O
+CaCl2+H2O
 (用电子式表示).
(用电子式表示).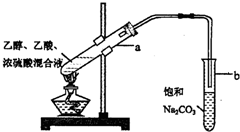
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.