题目内容
20.在加热情况下,用足量CO还原9g铁的氧化物,产生气体全部通入足量石灰水中得到12.5g沉淀,此铁的氧化物是( )| A. | FeO | B. | Fe3O4 | ||
| C. | Fe2O3 | D. | Fe3O4 和Fe2O3混合物 |
分析 12.5g沉淀为碳酸钙,根据n=$\frac{m}{M}$计算碳酸钙物质的量,进而计算二氧化碳的物质的量,CO获得氧化物中O原子转化为CO2,据此计算氧化物中氧原子物质的量,进而计算Fe原子物质的量,根据Fe、O原子数目之比判断.
解答 解:12.5g沉淀为碳酸钙,其物质的量为$\frac{12.5g}{100g/mol}$=0.125mol,由碳元素守恒可知,二氧化碳的物质的量为0.125mol,CO获得氧化物中O原子转化为CO2,故氧化物中n(O)=n(CO2)=0.125mol,则m(O)=0.125mol×16g/mol=2g,故氧化物中n(Fe)=$\frac{9g-2g}{56g/mol}$=0.125mol,n(Fe):n(O)=0.125mol:0.125mol=1:1,故氧化物为FeO,故选A.
点评 本题考查混合物反应有关计算,根据守恒法计算Fe、O原子数目之比,侧重考查学生分析计算能力,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
11.铁及其化合物在生产和生活中有广泛的应用.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的方法之一的反应原理为:Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
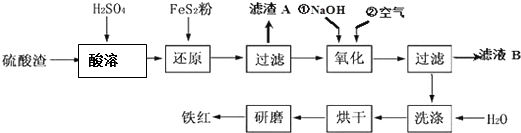
已知:①
②FeS2是一种黄色难溶于水的固体.
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式:FeS2+14 Fe3++8 H2O=15Fe2++2 SO42-+16 H+.
(3)为了确保铁红的质量和纯度,氧化过程中加NaOH调节溶液的pH的范围是3.2~3.8;如果加NaOH调节溶液的pH=a,则滤液B中的c(Fe3+)=4×10(4-3a)(25℃时,Ksp[Fe(OH)3]=4×10-38)
(4)滤液B中可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的方法之一的反应原理为:Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

已知:①
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式:FeS2+14 Fe3++8 H2O=15Fe2++2 SO42-+16 H+.
(3)为了确保铁红的质量和纯度,氧化过程中加NaOH调节溶液的pH的范围是3.2~3.8;如果加NaOH调节溶液的pH=a,则滤液B中的c(Fe3+)=4×10(4-3a)(25℃时,Ksp[Fe(OH)3]=4×10-38)
(4)滤液B中可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4.
8.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子变换法回收钒的新工艺,回收率达到91.7%.
部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如图所示:
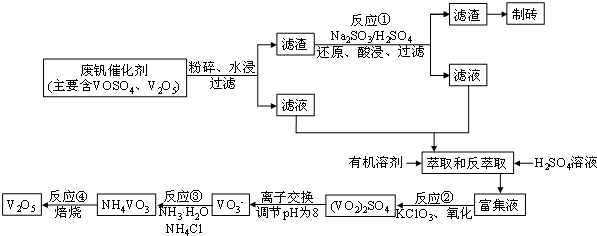
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
7.下列离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 除去CO2中的SO2:SO2+CO32-═CO2↑+SO32- | |
| C. | 0.01 mol SO2气体通入10 mL 1 mol/L的NaOH溶液中:SO2+OH-═HSO3- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
 2SO3(g)△H<0
2SO3(g)△H<0 浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
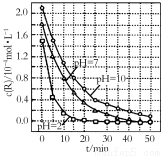
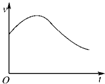 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快. ;
;
 强,R的降解速率越小
强,R的降解速率越小