��Ŀ����
����Ŀ���״�����Ϊȼ�ϵ�ص�ԭ�ϡ�CO2��CO����Ϊ��ҵ�ϳɼ״���CH3OH����ֱ��̼Դ��
��1����֪�ڳ��³�ѹ�£�
��CH3OH��l��+ O2��g��=CO��g�� + 2H2O��g���� ��H����355.0 kJ�Mmol
��2CO��g��+ O2��g��= 2CO2��g�� ��H����566.0 kJ/mol
��H2O��l��=H2O��g�� ��H��+44.0 kJ/mol
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ��___________________________
��2������CO��H2��һ�������¿ɺϳɼ״����������·�Ӧ��CO��g����2H2��g��=CH3OH��g���������ַ�Ӧ�����������ı仯��������ͼa��b��ʾ������˵����ȷ����__________
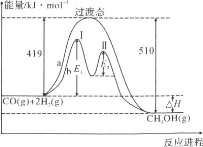
A��������Ӧ����H����91kJ��mol��1
B��a��Ӧ����Ӧ�Ļ��Ϊ510kJ��mol��1
C��b�����еڢ��Ϊ���ȷ�Ӧ���ڢ��Ϊ���ȷ�Ӧ
D��b����ʹ�ô������˷�Ӧ�Ļ�ܺ���H
E��b���̵ķ�Ӧ���ʣ��ڢ�Σ��ڢ��
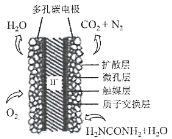
��3�������ǿ���С����Ƶ�һ���״�ȼ�ϵ�أ����ߵ���Ӱ����Ϊa��b���Ե缫���ֱ��õ������ձ���m��n�����ӣ�����ԭ��ʾ��ͼ��ͼ��
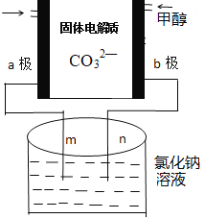
��b���缫��ӦʽΪ____________��
���ڱ�״���£���ͨ��112mL��O2���������ձ��е���Һ�����Ϊ200mL��������䣩���Ӧ��ֹʱ�ձ�����Һ��pHΪ______��
��4��������CO2���ݵ绯ѧԭ���Ʊ����ϣ��ȼ��ٹ�ҵ��������ϩ���������ִﵽ����CO2�ŷŵ�Ŀ�ġ�������������ĤΪ�����缫��ϡ����Ϊ�������Һ����һ��������ͨ��CO2���е�⣬���������Ƶõ��ܶȾ���ϩ![]() �����LDPE����
�����LDPE����
�ٵ��ʱ�������ĵ缫��Ӧʽ��________��
�ڹ�ҵ������1.4��102kg��LDPE����������Ҫ��״����________L��CO2��
���𰸡�CH3OH��l����![]() O2��g�� ===CO2��g����2H2O��l�� ��H����726.0 kJ/mol ACE CH3OH -6e-+3 CO32��== 4 CO2��2H2O 13 2n CO2 + 12nH+ + 12n e�� ==
O2��g�� ===CO2��g����2H2O��l�� ��H����726.0 kJ/mol ACE CH3OH -6e-+3 CO32��== 4 CO2��2H2O 13 2n CO2 + 12nH+ + 12n e�� == ![]() + 4n H2O 2.24��105
+ 4n H2O 2.24��105
��������
(1)��֪�ڳ��³�ѹ�£���CH3OH(l)+ O2(g)=CO(g) + 2H2O(g)�� ��H����355.0 kJ�Mmol����2CO(g)+ O2(g)= 2CO2(g) ��H����566.0 kJ/mol����H2O(l)=H2O(g) ��H��+44.0 kJ/mol���ɸ�˹���ɿ�֪����+����![]() - ����2��CH3OH(l)��
- ����2��CH3OH(l)��![]() O2(g) ===CO2(g)��2H2O(l)���ɴ˼�����H��
O2(g) ===CO2(g)��2H2O(l)���ɴ˼�����H��
(2)A�����������仯ͼ��������Ӧ���ʱ���H=����Ӧ���-�淴Ӧ��ܣ�
B��a��Ӧ����Ӧ�Ļ��Ϊ419KJ/mol��
C��ͼ�����߱仯�������仯��֪b�����еڢ��Ϊ���ȷ�Ӧ���ڢ��Ϊ���ȷ�Ӧ��
D����������ı䷴Ӧ���̣������ı䷴Ӧ����ЧӦ��
E��b���̵ķ�Ӧ����ȡ���ڷ�Ӧ��ܵĴ�С�����Խ��Ӧ����ԽС��
(3)�ٵõ��ӷ�����ԭ��Ӧ�ĵ缫Ϊ������ʧ���ӷ���������Ӧ�ĵ缫Ϊ������b�缫�ϼ״�ʧ���ӷ���������Ӧ��
�ڸ���ͼ֪��aΪ������bΪ����������Ȼ�����Һʱ��mΪ������nΪ���������ݵ��ط�Ӧʽ2NaCl+2H2O![]() H2��+Cl2+2NaOH������غ㷨���㣻
H2��+Cl2+2NaOH������غ㷨���㣻
(4)��2nCO2��![]() ��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ���д�õ缫��Ӧʽ��
��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ���д�õ缫��Ӧʽ��
�ڹ�ҵ������1.4��104kg��LDPE������2nCO2��![]() �������Ҫ������̼�����ʵ�����Ȼ�����V=nVm�������Ҫ����¶�����̼�������
�������Ҫ������̼�����ʵ�����Ȼ�����V=nVm�������Ҫ����¶�����̼�������
(1)��֪�ڳ��³�ѹ�£���CH3OH(l)+ O2(g)=CO(g) + 2H2O(g)�� ��H����355.0 kJ�Mmol����2CO(g)+ O2(g)= 2CO2(g) ��H����566.0 kJ/mol����H2O(l)=H2O(g) ��H��+44.0 kJ/mol���ɸ�˹���ɿ�֪����+����![]() - ����2��CH3OH(l)��
- ����2��CH3OH(l)��![]() O2(g) ===CO2(g)��2H2O(l)������H=(��355.0 kJ�Mmol)+(��566.0 kJ/mol)��
O2(g) ===CO2(g)��2H2O(l)������H=(��355.0 kJ�Mmol)+(��566.0 kJ/mol)��![]() - (+44.0 kJ/mol)��2=��726.0 kJ/mol���״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)��
- (+44.0 kJ/mol)��2=��726.0 kJ/mol���״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)��![]() O2(g) ===CO2(g)��2H2O(l) ��H����726.0 kJ/mol��
O2(g) ===CO2(g)��2H2O(l) ��H����726.0 kJ/mol��
(2)A��������Ӧ����H=(419-510)kJmol-1=-91kJmol-1����A��ȷ��
B��a��Ӧ����Ӧ�Ļ��Ϊ419kJmol-1����B����
C��ͼ�����߱仯�������仯��֪��b�����������������ߣ���ڢ��Ϊ���ȷ�Ӧ���ڢ���������������ڷ�Ӧ���ӦΪ���ȷ�Ӧ����C��ȷ��
D��b����ʹ�ô������˷�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ����ķ�Ӧ����H����D����
E��b�����еڢ�εĻ��С�ڵڢ�εĻ�ܣ���Ӧ����������Ӧ���ʣ��ڢ�Σ��ڢ�Σ���E��ȷ��
�ʴ�Ϊ��ACE��
(3)�ٵõ��ӷ�����ԭ��Ӧ�ĵ缫Ϊ������ʧ���ӷ���������Ӧ�ĵ缫Ϊ����������aΪ������bΪ������b�缫�ϼ״�ʧ���ӷ���������Ӧ���ɶ�����̼��������ӦʽΪCH3OH -6e-+3 CO32��= 4 CO2��2H2O��
�ڸ���ͼ֪��aΪ������bΪ����������Ȼ�����Һʱ��mΪ������nΪ���������ݵ��ط�Ӧʽ2NaCl+2H2O![]() H2��+Cl2��+2NaOH���ڱ�״���£���ͨ��112mL��O2�����ʵ���Ϊ
H2��+Cl2��+2NaOH���ڱ�״���£���ͨ��112mL��O2�����ʵ���Ϊ![]() =0.005mol��ת�Ƶ���Ϊ0.005mol��4=0.02mol��������ÿת��2mol��������2molNaOH�����������NaOH0.02mol��Ũ��Ϊ
=0.005mol��ת�Ƶ���Ϊ0.005mol��4=0.02mol��������ÿת��2mol��������2molNaOH�����������NaOH0.02mol��Ũ��Ϊ![]() =0.1mol/L����ҺpH=13��
=0.1mol/L����ҺpH=13��
(4)��2nCO2��![]() ��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ�ɵøõ缫��ӦʽΪ��2nCO2+12e-+12nH+=
��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ�ɵøõ缫��ӦʽΪ��2nCO2+12e-+12nH+=![]() +4nH2O��
+4nH2O��
�ڹ�ҵ������1.4��102kg��LDPE������2nCO2��LDPE��֪����Ҫ������̼�����ʵ���Ϊ��![]() ��2n=1��104mol����������Ҫ��״����CO2������ǣ�22.4L/mol��1��104mol=2.24��105��
��2n=1��104mol����������Ҫ��״����CO2������ǣ�22.4L/mol��1��104mol=2.24��105��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���ڵ����仯����Ļ��������У����йط�Ӧ�ķ�Ӧԭ�������о�������Ҫ���塣
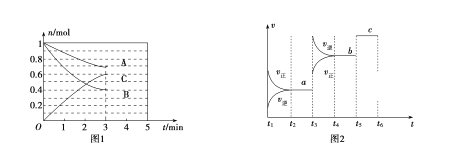
(1)t��ʱ������N2��NH3��������Ӧ����Ϣ���±���ʾ��
��ѧ��Ӧ | ����Ӧ��� | �淴Ӧ��� | t��ʱƽ�ⳣ�� |
N2(g)��O2(g)��2NO(g) ��H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)��5O2(g)��4NO(g)��6H2O(g) ��H<0 | c kJ/mol | d kJ/mol | K2 |
��д��t��ʱ������һ����������������������Ȼ�ѧ����ʽ��______________________��t��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________ (��K1��K2��ʾ)��
(2)��ҵ�ϳɰ���ԭ��Ϊ��N2(g)��3H2(g)![]() 2NH3(g)��ͼ�ױ�ʾ��һ��������ܱ������з�Ӧʱ��H2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£���ʼͶ��H2��N2�����ʵ���֮��(��Ϊx)��ƽ��ʱNH3�����ʵ��������Ĺ�ϵ��
2NH3(g)��ͼ�ױ�ʾ��һ��������ܱ������з�Ӧʱ��H2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£���ʼͶ��H2��N2�����ʵ���֮��(��Ϊx)��ƽ��ʱNH3�����ʵ��������Ĺ�ϵ��

��ͼ����0��t1 min�ڣ�v(N2)��_____mol��L��1��min��1��b���v(H2)��_____a���v(H2)��(������������С��������������)��
�ڼ�֪ij�¶��¸÷�Ӧ��ƽ��ʱ�����ʾ�Ϊ1 mol���������Ϊ1L�������¶Ⱥ�ѹǿ���䣬�ֳ���3 mol N2��ƽ��________(���������ƶ����������ƶ����������ƶ���)��
(3)����ѧ���о���������Ϊ������ȼ�ϵ���¼����������ֵ�ؿ�ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ�����ܷ��硣����ȼ�ϵ�ؽṹ��ͼ��ʾ��д�������缫��Ӧʽ��________________________________________________��
�������ϵ�ع���ʱ��ÿ���ı�״����2.24 L O2ʱ���ɲ����ĵ���Ϊ________ (�����ڳ���Ϊ96500C/ mol)��
����Ŀ��![]() �ǹ�ҵ�ϳ��õ�������֪
�ǹ�ҵ�ϳ��õ�������֪![]() ����Ԫ����
����Ԫ����![]() �ۣ������ȶ�����ˮ������᪻���Ӧ���������л��ܼ���ʵ���ҳ���
�ۣ������ȶ�����ˮ������᪻���Ӧ���������л��ܼ���ʵ���ҳ���![]() �봿���������Ʊ�
�봿���������Ʊ�![]() ����Ӧ�漰���ļ������ʵ��۷е����£�
����Ӧ�漰���ļ������ʵ��۷е����£�
���� |
|
|
|
|
�е� | 47 |
| 77 | 137 |
�۵� |
|
|
|
|
ʵ������������װ���Ʊ�![]() (���ּг���������ȥ)��
(���ּг���������ȥ)��
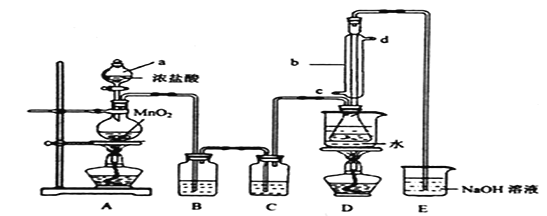
�ش��������⣺
(1)װ����b��������������Ϊ_________��д���Ʊ�![]() �Ļ�ѧ����ʽ_________��
�Ļ�ѧ����ʽ_________��
(2)D�в�����ˮԡ���ȵ�ԭ���� _________����Ӧ���������ƿ�ڻ�����з������Ʒ�ķ�����______��
(3)ʵ������У���ȱ��Cװ�ã����ֲ�Ʒ���Dz��壬���ָ������ԭ��ѧ����ʽ��ʾΪ______________��
(4)��ʵʼװ����ƴ���ȱ�ݣ���ĸĽ������� _________________________________��