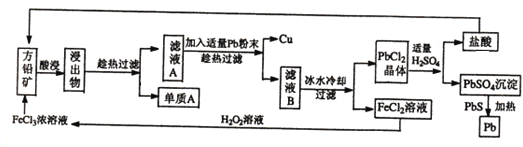
题目内容
【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
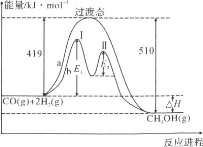
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
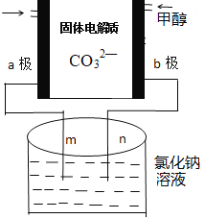
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
【答案】4NH3(g)+6NO(g)= N2(g) +6H2O(g) △H=(c-d-5a+5b) kJ/mol K=![]()
![]() mol/(Lmin) 大于 不移动 CO(NH2)2+H2O-6e-=CO2+N2+6H+ 38600c
mol/(Lmin) 大于 不移动 CO(NH2)2+H2O-6e-=CO2+N2+6H+ 38600c
【解析】
(1)已知△H=正反应活化能-逆反应活化能,则①N2(g)+O2(g)=2NO(g) △H=(a-b)kJ/mol >0,②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=(c-d)kJ/mol <0,由盖斯定律知:②-①×5得4NH3(g)+6NO(g)= N2(g) +6H2O(g),据此计算反应△H并写出该反应的平衡常数;
(2) ①图甲中0~t1 min内,H2的变化浓度为0.6mol/L-0.3mol/L=0.3mol/L,由N2(g)+3H2(g)![]() 2NH3(g)可知N2的变化浓度为0.3mol/L×
2NH3(g)可知N2的变化浓度为0.3mol/L×![]() =0.1mol/L,再根据v(N2)=
=0.1mol/L,再根据v(N2)=![]() 计算;根据浓度越大,反应速率越快判断b点与a点的速率大小;
计算;根据浓度越大,反应速率越快判断b点与a点的速率大小;
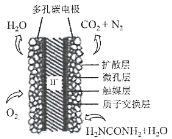
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,则平衡常数K=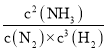 =
=![]() =1,保持温度和压强不变,又充入3 mol N2,此时容器的体积变为2L,则N2、H2和NH3的浓度瞬间变为2mol/L、0.5mol/L和0.5mol/L,根据Qc=
=1,保持温度和压强不变,又充入3 mol N2,此时容器的体积变为2L,则N2、H2和NH3的浓度瞬间变为2mol/L、0.5mol/L和0.5mol/L,根据Qc=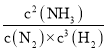 判断平衡移动的方向;
判断平衡移动的方向;
(3)①由尿素燃料电池的结构可知,正极上氧气得到电子生成水,负极上尿素失去电子生成氮气和二氧化碳;
②标准状况下2.24 L O2的物质的量为![]() =0.1mol,转移电子的物质的量为0.4mol,再计算产生的电量。
=0.1mol,转移电子的物质的量为0.4mol,再计算产生的电量。
(1) 已知△H=正反应活化能-逆反应活化能,则①N2(g)+O2(g)=2NO(g) △H=(a-b)kJ/mol >0,②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=(c-d)kJ/mol <0,由盖斯定律知:②-①×5得4NH3(g)+6NO(g)= N2(g) +6H2O(g),即△H=(c-d)kJ/mol -[(a-b)]kJ/mol×5=(c-d-5a+5b) kJ/mol,则t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式为4NH3(g)+6NO(g)= N2(g) +6H2O(g) △H=(c-d-5a+5b) kJ/mol,t℃时此反应的平衡常数为K=![]() ;
;
(2)①图甲中0~t1 min内,H2的变化浓度为0.6mol/L-0.3mol/L=0.3mol/L,由N2(g)+3H2(g)![]() 2NH3(g)可知N2的变化浓度为0.3mol/L×
2NH3(g)可知N2的变化浓度为0.3mol/L×![]() =0.1mol/L,则v(N2)=
=0.1mol/L,则v(N2)=![]() =
=![]() =
=![]() mol/(Lmin);根据浓度越大,反应速率越快可知b点的v(H2)正大于a点的v(H2)逆;
mol/(Lmin);根据浓度越大,反应速率越快可知b点的v(H2)正大于a点的v(H2)逆;
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,则平衡常数K=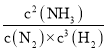 =
=![]() =1,保持温度和压强不变,又充入3 mol N2,此时容器的体积变为2L,则N2、H2和NH3的浓度瞬间变为2mol/L、0.5mol/L和0.5mol/L,根据Qc=
=1,保持温度和压强不变,又充入3 mol N2,此时容器的体积变为2L,则N2、H2和NH3的浓度瞬间变为2mol/L、0.5mol/L和0.5mol/L,根据Qc=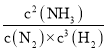 =
=![]() =1=K,则此时平衡不移动;
=1=K,则此时平衡不移动;
(3)①由尿素燃料电池的结构可知,负极上尿素失去电子生成氮气和二氧化碳,负极反应为CO(NH2)2+H2O-6e-=CO2+N2+6H+;
②标准状况下2.24 L O2的物质的量为![]() =0.1mol,转移电子的物质的量为0.4mol,则可产生的电量为96500C/ mol×0.4mol=38600c。
=0.1mol,转移电子的物质的量为0.4mol,则可产生的电量为96500C/ mol×0.4mol=38600c。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 溶液橙色变深 | 增大生成物浓度,平衡 |
B | 向较浓的 |
|
|
C | 取 | 溶液中出现砖红色 | 淀粉完全水解 |
D | 分别向 | 加入 | 反应物的浓度越大,反应速率越快 |
A.AB.BC.CD.D