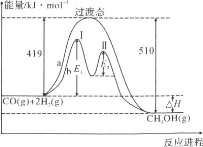
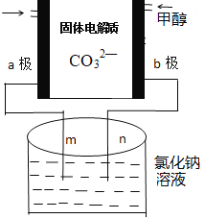
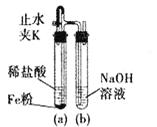
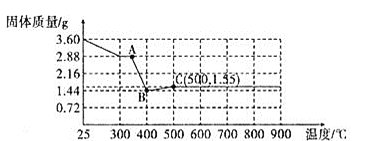
��Ŀ����
����Ŀ��![]() �ǹ�ҵ�ϳ��õ�������֪
�ǹ�ҵ�ϳ��õ�������֪![]() ����Ԫ����
����Ԫ����![]() �ۣ������ȶ�����ˮ������᪻���Ӧ���������л��ܼ���ʵ���ҳ���
�ۣ������ȶ�����ˮ������᪻���Ӧ���������л��ܼ���ʵ���ҳ���![]() �봿���������Ʊ�
�봿���������Ʊ�![]() ����Ӧ�漰���ļ������ʵ��۷е����£�
����Ӧ�漰���ļ������ʵ��۷е����£�
���� |
|
|
|
|
�е� | 47 |
| 77 | 137 |
�۵� |
|
|
|
|
ʵ������������װ���Ʊ�![]() (���ּг���������ȥ)��
(���ּг���������ȥ)��
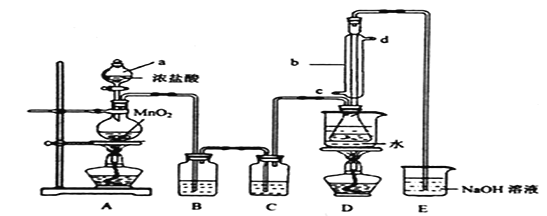
�ش��������⣺
(1)װ����b��������������Ϊ_________��д���Ʊ�![]() �Ļ�ѧ����ʽ_________��
�Ļ�ѧ����ʽ_________��
(2)D�в�����ˮԡ���ȵ�ԭ���� _________����Ӧ���������ƿ�ڻ�����з������Ʒ�ķ�����______��
(3)ʵ������У���ȱ��Cװ�ã����ֲ�Ʒ���Dz��壬���ָ������ԭ��ѧ����ʽ��ʾΪ______________��
(4)��ʵʼװ����ƴ���ȱ�ݣ���ĸĽ������� _________________________________��
���𰸡�ֱ�������� ![]() �������
�������![]() ���� ����
���� ���� ![]() ��D��E֮�����Ӹ���װ��
��D��E֮�����Ӹ���װ��
��������
(1)���������Ĺ����������![]() �봿����������Ӧ����
�봿����������Ӧ����![]() ��
��![]() ��
��
(2)���ݱ������ݽ�Ϸе��жϣ�
(3)����ԭ���غ㡢�����غ�д����ѧ����ʽ��
(4)����![]() ��ˮ��Ӧ��ԭ����ơ�
��ˮ��Ӧ��ԭ����ơ�
(1)װ��bΪ�����ܣ���![]() �봿���������Ʊ�
�봿���������Ʊ�![]() �Ļ�ѧ����ʽΪ
�Ļ�ѧ����ʽΪ![]() ���ʴ�Ϊ�������ܣ�
���ʴ�Ϊ�������ܣ�![]() ��
��
(2)���ݱ������ʵķе�ߵͣ�Ϊ��ʹ![]() ƽ���������������
ƽ���������������![]() ���������Բ���ˮԡ���ȵķ������������ʵ��۷е㣬����ƿ�ڻ�����з����
���������Բ���ˮԡ���ȵķ������������ʵ��۷е㣬����ƿ�ڻ�����з����![]() �ķ������������¶���
�ķ������������¶���![]() ��
��
�ʴ�Ϊ���������![]() ����������
����������
(3)��ȱ��Cװ�ã��������л���ˮ������![]() ��ˮ�з���᪻���Ӧ������ɫ�̼�����ζ������������л�ɫ�������ɣ���ɫ�̼�����ζ������Ȼ����⣬����������ԭ��Ӧ��Ԫ�ػ��ϼ۱仯�غ��ƶϣ����ϼ۽��͵����ɻ�ɫ����Ϊ�������ϼ����ߵ����ɶ����������壬����ԭ���غ㡢�����غ�д����ѧ����ʽΪ��
��ˮ�з���᪻���Ӧ������ɫ�̼�����ζ������������л�ɫ�������ɣ���ɫ�̼�����ζ������Ȼ����⣬����������ԭ��Ӧ��Ԫ�ػ��ϼ۱仯�غ��ƶϣ����ϼ۽��͵����ɻ�ɫ����Ϊ�������ϼ����ߵ����ɶ����������壬����ԭ���غ㡢�����غ�д����ѧ����ʽΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
(4)Ϊ�˷�ֹװ��E�е�ˮ�����ص��ܽ�����ƿ��![]() ��ˮ��Ӧ�����ʽ��ͣ�Ӧ��D��E֮�����Ӹ���װ�ã�
��ˮ��Ӧ�����ʽ��ͣ�Ӧ��D��E֮�����Ӹ���װ�ã�
�ʴ�Ϊ����D��E֮�����Ӹ���װ�á�

����Ŀ������ʵ�����������ͽ��۾���ȷ����
ѡ�� | ʵ����� | ʵ������ | ʵ����� |
A | �� | ��Һ��ɫ���� | ����������Ũ�ȣ�ƽ�� |
B | ���Ũ�� |
|
|
C | ȡ | ��Һ�г���ש��ɫ | ������ȫˮ�� |
D | �ֱ��� | ���� | ��Ӧ���Ũ��Խ��Ӧ����Խ�� |
A.AB.BC.CD.D