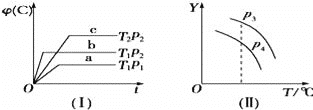
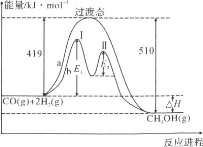
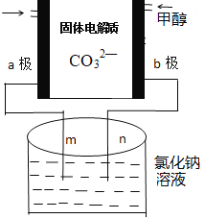
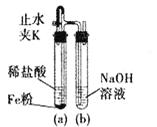
题目内容
【题目】0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式为( )
A.C2H4B.C2H6OC.C2H6O2D.C4H6O3
【答案】B
【解析】
硫酸具有吸水性,质量增加了10.8g,即生成水的质量为10.8g,产物通过灼热的氧化铜,氧化铜的质量减轻了3.2g,可计算出参与反应的CO和反应生成的CO2的质量,进一步计算其物质的量,通过碱石灰时,碱石灰的质量增加了17.6g,可计算出总的CO2的物质的量,根据氧元素守恒可计算出有机物中含有的氧元素的物质的量,根据C、H、O三种原子的物质的量之比判断化学式。
硫酸具有吸水性,质量增加了10.8g,即生成水的质量为10.8g,n(H2O)=![]() =0.6mol,则n(H)=0.6mol×2=1.2mol;产物通过灼热的氧化铜,氧化铜的质量减轻了3.2g,
=0.6mol,则n(H)=0.6mol×2=1.2mol;产物通过灼热的氧化铜,氧化铜的质量减轻了3.2g,
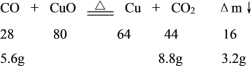
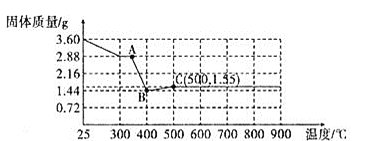
由此可知燃烧产物中CO的物质的量为![]() =0.2mol;
=0.2mol;
燃烧产物通过碱石灰时,碱石灰的质量增加了17.6g,增加的是CO2的质量,那么燃烧产物中CO2的质量为17.6-8.8=8.8g,物质的量为![]() =0.2mol;
=0.2mol;
根据碳元素守恒可知0.2mol有机物含有碳原子的物质的量为0.4mol,即1mol有机物含有碳原子的物质的量为2mol;根据氢元素守恒可知0.2mol有机物含有氢原子的物质的量为1.2mol,即1mol有机物含有碳原子的物质的量为6mol;根据氧元素守恒可知0.2mol有机物含有氧原子的物质的量为0.2mol+0.2mol×2+0.6mol-0.5mol×2=0.2mol,即1mol有机物含有氧原子的物质的量为1mol;因此1mol有机物中,n(C): n(H): n(O)=2:6:1,,有机物的分子式为C2H6O;
答案选B。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 溶液橙色变深 | 增大生成物浓度,平衡 |
B | 向较浓的 |
|
|
C | 取 | 溶液中出现砖红色 | 淀粉完全水解 |
D | 分别向 | 加入 | 反应物的浓度越大,反应速率越快 |
A.AB.BC.CD.D