题目内容
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
【答案】MgO>CaO>NaCl>KCl 1s22s22p63s23p63d104s1 C  水的熔、沸点较高,结冰时密度减小 正四面体
水的熔、沸点较高,结冰时密度减小 正四面体
【解析】
(1)影响晶体晶格能大小的因素有离子半径以及离子所带电荷的多少,晶格能越大熔点越高;
(2)①Cu的原子序数为29,结合能量最低原理和洪特规则的特例书写电子排布式;Cu为面心立方密堆积;
②Cu2+提供空轨道,水中氧原子提供孤电子对,形成配位键;
③氢键较一般分子间作用力强,影响物质的物理性质;
④计算S原子价层电子对数与孤电子对数,判断SO42-的空间结构。
(1)离子半径Mg2+<Na+<O2-<Ca2+ <Cl-,离子电荷数Na+= Cl-< O2-= Mg2+= Ca2+,离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl;
正确答案:MgO>CaO>NaCl>KCl。
(2)①Cu的原子序数为29,电子排布式为1s22s22p63s23p63d104s1,Cu为面心立方密堆积,配位数为12,故C符合;
正确答案:1s22s22p63s23p63d104s1 ;C。
②Cu2+提供空轨道,水中氧原子提供孤电子对,形成配位键,水合铜离子的结构简式为: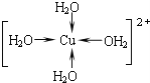 ;
;
正确答案: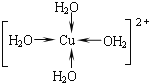 。
。
③氢键较一般分子间作用力强,所以水的熔、沸点较高,因为氢键具有方向性,结冰时,氢键增多,体积增大,密度减小;
正确答案:水的熔、沸点较高,结冰时密度减小。
④SO42﹣中心原子S的价层电子对数=4+![]() =4、孤电子对数为0,为正四面体结构;
=4、孤电子对数为0,为正四面体结构;
正确答案:正四面体。