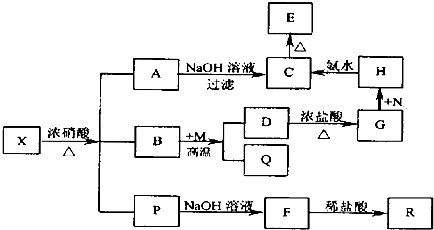
题目内容
12.下列有关电解质溶液中微粒的物质的量浓度关系不正确的是( )| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
分析 A、NaHCO3溶液呈碱性,水解大于电离,所以c(H2CO3)>c(CO32-),而水解和电离的程度微弱;
B、在0.1mol•L-1Na2CO3溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒:c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)],二者联式可得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3);
C、0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液,恰好完全反应生成等物质的量浓度的NaHCO3和Na2CO3溶液,碳酸钠的水解程度大于碳酸氢钠,所以c(CO32-)<c(HCO3-);
D、CH3COONa和CH3COOH混合溶液PH=7,显示中性,据电荷守恒、溶液组成来判断.
解答 解:A、在O.1mol/lNaHC03溶液中,HCO3-的水解程度大于电离程度:c(Na+)>c(HCO3-)>c(H2C03)>c(CO32-),故A正确;
B、在0.1mol•L-1Na2CO3溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒:c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)],二者联式可得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B正确;
C、0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液,恰好完全反应生成等物质的量浓度的NaHCO3和Na2CO3溶液,碳酸钠的水解程度大于碳酸氢钠,所以c(CO32-)<c(HCO3-),故C错误;
D、CH3COONa和CH3COOH混合溶液PH=7,c(H+)=c(OH-),根据电荷守恒,所以c(Na+)=c(CH3COO-)=O.1mol/l,故D正确;
故选C.
点评 本题涉及盐的水解原理的应用、离子浓度大小比较等知识,注意电荷守恒、物料守恒以及质子守恒的应用是关键,难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | K+、Cl-、SO${\;}_{4}^{2-}$、Al3+ | B. | Fe2+、NO${\;}_{3}^{-}$、Na+、Cl- | ||
| C. | S2-、Na+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$ | D. | SO${\;}_{3}^{2-}$、K+、NO${\;}_{3}^{-}$、Cl- |
| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为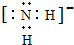 .
.(2)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式CO-2e-+O2-═CO2.
(3)关于该电池的下列说法,正确的是AC.
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高.
| A. | 不能自发进行的氧化还原反应,也可以通过电解来实现 | |
| B. | 电解质溶液导电是化学变化,金属导电是物理变化 | |
| C. | 电解池和原电池中均发生氧化还原反应 | |
| D. | 电解、电离、原电池均需要通电 |
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |