题目内容
17.(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有温度和浓度.(2)元素周期表共有7周期,16族;同一周期元素的原子电子层相同.
(3)在${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、${\;}_{12}^{23}$Mg、${\;}_{12}^{24}$Mg和${\;}_{29}^{65}$Cu中共有3种元素,6种原子.
分析 (1)根据外界条件温度、浓度、压强、催化剂等等的改变,速率发生变化来分析;
(2)元素周期表共有7个横行,18个纵行.每一个横行叫做一个周期,纵行称作族,共有16个族,又分为7个主族(ⅠA-ⅦA)、7个副族(ⅠB-ⅦB)、一个第Ⅷ族(包括8、9、10三个纵行)、一个零族;
(3)质子数决定元素的种类,质子数和中子数决定原子的种类,中子数=质量数-中子数,分子的相对分子质量在数值上等于各个原子的质量数之和.
解答 解:(1)因当加热或加入浓盐酸后,反应速率明显加快,所以影响化学反应速率的因素有温度和浓度.故答案为:温度;浓度;
(2)元素周期表共有7个横行,18个纵行.把原子电子层数目相同的元素排在同一横行内,每一个横行叫做一个周期,共有7个周期,纵行称作族,共有16个族,又分为7个主族(ⅠA-ⅦA)、7个副族(ⅠB-ⅦB)、一个第Ⅷ族(包括8、9、10三个纵行)、一个零族;故答案为:7;16;电子层;
(3)在11H,12H,13H,1223Mg,1224Mg,2965Cu中有氢元素、镁元素和铜元素三种,这6种微粒均具有一定数目的质子数和一定数目的中子数,均属于不同原子,共有6种原子,
故答案为:3;6.
点评 本题考查影响化学反应速率的外界因素、元素周期表的结构、元素及核素的概念,比较基础,注意对基础知识的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.依据元素周期律,下列推断中正确的是( )
| A. | KOH比NaOH碱性强 | |
| B. | H3BO3的酸性比H2CO3的酸性强 | |
| C. | HCl、H2S、H3P的还原性性逐渐减弱 | |
| D. | 若M+和R2-的核外电子层结构相同,则离子半径M+>R2- |
12.下列有关电解质溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
9.下列物质中,有共价键的单质是( )
| A. | N2 | B. | CH4 | C. | NaCl | D. | MgCl2 |
6.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 11.2 LNH3中所含的质子数为5NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| C. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA 个 |
20.下列相关反应的离子方程式书写正确的是( )
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |

 .
.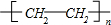 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).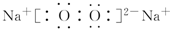 .
.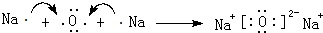 .羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子
.羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子 .
. 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.