题目内容
7.短周期元素X、Y、Z、W在周期表中的位置关系如表所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为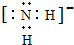 .
.(2)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式CO-2e-+O2-═CO2.
(3)关于该电池的下列说法,正确的是AC.
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高.
分析 由短周期元素X、Y、Z、W在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,在同周期元素的常见简单离子中,W的简单离子半径最小,则W为Al,可推知X为C、Y为N、Z为O.
(1)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-;
(2)(3)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,电流由正极通过导线流向负极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大.
解答 解:由短周期元素X、Y、Z、W在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,在同周期元素的常见简单离子中,W的简单离子半径最小,则W为Al,可推知X为C、Y为N、Z为O.
(1)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-,NH2-中N原子与H原子之间形成1对共用电子对,其电子式为: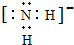 ,故答案为:
,故答案为: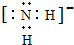 ;
;
(2)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO-2e-+O2-═CO2,
故答案为:CO-2e-+O2-═CO2;
(3)A.工作时电极b通入空气,b作正极,阴离子向负极移动,O2-由电极b流向电极a,故A正确;
B.原电池放电时电子从负极流向正极,故电流由电极b通过传感器流向电极a,故B错误;
C.一氧化碳的含量越大,原电池放电时产生的电流越大,故C正确,
故答案为:AC.
点评 本题考查结构性质关系应用,涉及电子式、原电池等,推断应是解题关键,侧重对学生综合能力与基础知识的掌握.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
17.下列关于如图所示装置的叙述,正确的是( )
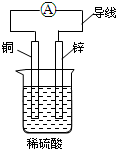

| A. | 锌片为负极,铜片为正极 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 铜片发生的反应为Cu-2e-═Cu2+ | |
| D. | 电流方向是由锌片通过导线流向铜片 |
15.在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( )
| A. | NF3 | B. | CH${\;}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
2.下列图象分别表示有关反应的反应过程与能量变化的关系( )
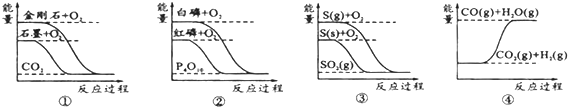
据此判断下列说法中正确的是( )

据此判断下列说法中正确的是( )
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,等质量S(g)和S(s)的能量比较,S(s)能量较高 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 |
12.下列有关电解质溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
19.某有机物分子式为C4H8,核磁共振氢谱图显示该物质有两组峰,且峰面积比为3:1,该有机物的结构有几种( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 5种 |
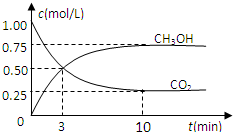 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示. ,CO2
,CO2 .
.