题目内容
20.X、Y、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3; R2+离子的3d轨道中有9个电子.请回答下列问题:(1)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是2Cu+8 NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.
(2)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键.
分析 X、Y、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体,X与氢元素可形成XH3,应分别为NO2、NH3,则X为N元素、Y为O元素; R2+离子的3d轨道中有9个电子,R2+离子核外电子排布为1s22s22p63s23p63d9,则R原子核外电子数为2+8+17+2=29,故R为Cu,据此解答.
解答 解:X、Y、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体,X与氢元素可形成XH3,应分别为NO2、NH3,则X为N元素、Y为O元素; R2+离子的3d轨道中有9个电子,R2+离子核外电子排布为1s22s22p63s23p63d9,则R原子核外电子数为2+8+17+2=29,故R为Cu.
(1)将Cu单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,生成[Cu(NH3)4]2+,该反应的离子方程式是:2Cu+8 NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O,
故答案为:2Cu+8 NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
(2)NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键,
故答案为:NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键.
点评 本题考查结构性质位置关系用,推断元素是解题关键,侧重对配合物的考查,(2)中注意从电负性理解分析,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列说法不正确的是( )
| A. | 某微粒空间构型为三角锥形,则该微粒一定是极性分子 | |
| B. | 某微粒空间构型为V形,则中心原子一定有孤电子对 | |
| C. | NH4+中N-H键能、键长和键角均相同 | |
| D. | SiF4和SO${\;}_{3}^{2-}$的中心原子均为sp3杂化,其立体构型都是正四面体 |
8.依据元素周期律,下列推断中正确的是( )
| A. | KOH比NaOH碱性强 | |
| B. | H3BO3的酸性比H2CO3的酸性强 | |
| C. | HCl、H2S、H3P的还原性性逐渐减弱 | |
| D. | 若M+和R2-的核外电子层结构相同,则离子半径M+>R2- |
15.在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( )
| A. | NF3 | B. | CH${\;}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
12.下列有关电解质溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
9.下列物质中,有共价键的单质是( )
| A. | N2 | B. | CH4 | C. | NaCl | D. | MgCl2 |
 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+. .
. .羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子
.羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子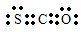 .
. 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl