题目内容
【题目】镓(31Ga)、锗(32Ge)都是重要的稀有金属,在化学催化剂、半导体材料、新能源等领域应用广泛,可从锗煤燃烧后的粉煤灰(含 Ga2O3、GeO2、SiO2、Al2O3)中提取, 部分流程如下:

已知:
物质 | GaCl3 | GeCl4 | AlCl3 |
沸点/℃ | 201 | 84 | 183(升华) |
(1)滤渣的主要成分为_____。
(2)①中发生的反应有 Al2O3+6H+=2Al3++3H2O、Ga2O3+6H+=2Ga3++3H2O 和_____。
(3)操作 a 的名称是_____,②中控制温度的范围是_____(填字母序号)。
a.20~84℃ b.84~183℃ c.84~201℃
(4)④中发生反应的化学方程式是__________________________________________。
(5)镓能与沸水剧烈反应生成氢气,锗在加热条件下与盐酸或稀硫酸不反应。从原子结构角度解释其原因:______________________
(6)用浓盐酸酸化的磷酸三丁酯(TBP)可以从残液中萃取 Ga3+,相关反应为:TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
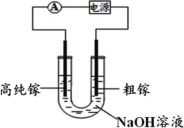
(7)电解法可以提纯粗镓,具体原理如图所示。镓在阳极溶解生成的 Ga3+与 NaOH 溶液反应生成 GaO![]() ,GaO
,GaO![]() 在阴极放电的电极反应式是_____________________。
在阴极放电的电极反应式是_____________________。
【答案】SiO2 GeO2+4H++4Cl-=GaCl4+2H2O 蒸馏 b GeO2+2H2![]() Ge+2H2O 镓和锗均为第4周期的主族元素,镓的最外层电子数为3,锗的最外层电子数为4,故镓的金属性较强,锗的金属性较弱 当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl
Ge+2H2O 镓和锗均为第4周期的主族元素,镓的最外层电子数为3,锗的最外层电子数为4,故镓的金属性较强,锗的金属性较弱 当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 向逆反应方向移动,故可对有机相进行反萃取 GaO
向逆反应方向移动,故可对有机相进行反萃取 GaO![]() +3e- +2H2O=Ga+4OH-
+3e- +2H2O=Ga+4OH-
【解析】
由流程可知,粉煤灰经浓盐酸浸取,过滤后的滤液中经蒸馏,分离出四氯化锗,将四氯化锗与水混合搅拌24h,可以发生水解得到GeO2,最后GeO2被氢气还原为Ge。
(1)粉煤灰中的SiO2不与盐酸反应,所以,滤渣的主要成分为SiO2。
(2)由题中信息可知,Ga2O3、GeO2、Al2O3皆可溶于盐酸,所以,①中发生的反应有Al2O3+6H+=2Al3++3H2O、Ga2O3+6H+=2Ga3++3H2O和GeO2+4H++4Cl-=GaCl4+2H2O。
(3)由题中信息可知,四氯化锗的沸点较低,操作 a 需要控制温度,故其为蒸馏,蒸馏时要防止氯化镓和氯化铝气化,故②中控制温度的范围是84~183℃ ,答案选b。
(4)④中GeO2被氢气还原为Ge,发生反应的化学方程式是GeO2+2H2![]() Ge+2H2O。
Ge+2H2O。
(5)镓能与沸水剧烈反应生成氢气,锗在加热条件下与盐酸或稀硫酸不反应。从原子结构角度解释其原因:镓和锗均为第4周期的主族元素,镓的最外层电子数为3,锗的最外层电子数为4,故镓的金属性较强,锗的金属性较弱。
(6)用浓盐酸酸化的磷酸三丁酯(TBP)可以从残液中萃取Ga3+,相关反应为:TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 。根据平衡移动原理可知,当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl
。根据平衡移动原理可知,当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 向逆反应方向移动,故可对有机相进行反萃取。
向逆反应方向移动,故可对有机相进行反萃取。
(7)电解法可以提纯粗镓,镓在阳极溶解生成的Ga3+与 NaOH 溶液反应生成 GaO![]() ,GaO
,GaO![]() 在阴极放电生成Ga,其电极反应式是GaO
在阴极放电生成Ga,其电极反应式是GaO![]() +3e-+2H2O=Ga+4OH-。
+3e-+2H2O=Ga+4OH-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na

